|
|
|
Constitution et transformation de la matière |
|||||||||||||||
|
|
|
Animations |
Vidéos de cours |
||||||||||||
|
Cours : Activités expérimentales Puissances de
10, notation scientifique Unités légales
du système international / conversion Méthode de
résolution d’exercices Résoudre une
équation à une inconnue Programme officiel
|
Exercices de révision 1.
dilution d’une solution de sulfate de cuivre 1.
à propos de l'aspirine (d'après bac 2004) utilisation de pH=-log[H3O +]; calcul de
xf à partir du pH puis de la conductivité; réaction partielle (question
Q1 uniquement) Corrigé 2.
l'acide ascorbique équation chimique partielle acide base; calcul de la
quantité d'ion oxonium avant réaction; calcul de concentrations finales Corrigé |
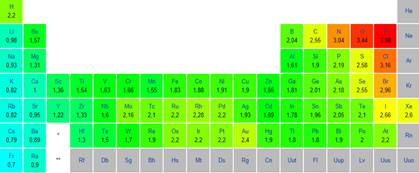
Tableau
périodique avec les propriétés des éléments ainsi que leur valeur d'électronégativité.
|
Attention !
Ces vidéos correspondent à l’ancien
programme, dans lequel on simplifiait les notations, en n’utilisant pas la
concentration standard cO
I-1 pH d'une solution
|
||||||||||||