|
|
|
Constitution et transformation de la matière |
|||||||||||
|
|
|
Animations |
Vidéos de cours |
||||||||
|
Cours : Activités expérimentales Puissances de
10, notation scientifique Unités légales
du système international / conversion Méthode de
résolution d’exercices Résoudre une
équation à une inconnue Programme officiel
|
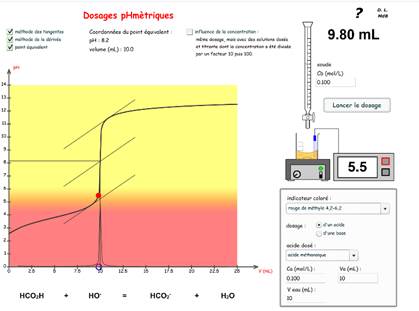
1. Dosage d'un produit ménager par une base
forte Corrigé 2. Dosage d'un vinaigre (Ministère) corrigé Corrigé 4. Ethanoate de sodium Corrigé 5. Etude de l’acide ascorbique ( Antilles
2014) 6. acide citrique (Polynésie 2014) groupe
caractéristique ; AH+3HO-;
titrage ; calcul d’incertitude ; calorimétrie 7. ds, version 1 (Novembre 2020) sur les chapitres 1,2,3 Dosage par
étalonnage ; spectrophotométrie ; groupe caractéristique ;
dosage pHmétrique 8. ds, version 2 (Novembre 2020) sur les chapitres 1,2,3 Dosage par
étalonnage conductimétrique ;
groupe caractéristique ; dosage pHmétrique 9. ds, version 3 (Novembre 2020) sur les chapitres 1,2,3 Dosage par
étalonnage ; ; groupe caractéristique ; dosage pHmétrique ;
indicateur coloré 10. ds, version 4 (Novembre 2020) sur les chapitres 1,2,3 Dosage par
étalonnage ; ; groupe caractéristique ; dosage pHmétrique ;
indicateur coloré |
Effectuer
le quiz : conversion et mesures de volume
Effectuer le quiz : conversion et mesures de masse
Méthode des tangentes.
titrage pH-métrique et colorimétrique
|
Qu’est-ce
qu’un dosage direct ? 0:59 Définition
de l'équivalence 2:33 Evolution
des quantités de matière au cours d'un dosage 5:06 Qu’’est-ce-qu’un dosage pHmétrique ?
4:30 Equivalence
au cours d'un dosage conductimétrique 9 :12 Comment
déterminer l’équivalence au cours d’un dosage colorimétrique ?
2 :49
|
||||||||