T.P. 3 Représentation
de Lewis et géométrie de quelques molécules
Objectif -
utilisation des modèles moléculaires
-
chercher la représentation de Lewis de quelques molécules simples et construire
leur modèle éclaté (avec les liaisons chimiques représentées).
I)
Rappel
La liaison
covalente :
Dans
une molécule, les atomes mettent en commun des électrons de leur couche externe
afin d’acquérir une structure stable en duet ou en octet.
Une
liaison covalente entre deux atomes correspond à une mise en commun de deux
électrons de leurs couches externes pour former un doublet d’électrons appelé
doublet liant. Les deux électrons mis en commun sont localisés entre les deux
atomes. Elle se représente par un tiret entre les symboles des deux atomes.Le
nombre de liaisons covalentes que peut former un atome est égal au nombre
d’électrons qui manque sur sa couche externe pour avoir la structure stable en
duet ou en octet.
Exemples :
·
L’atome d’hydrogène : (K)1, il doit acquérir un
électron pour obtenir la structure stable en duet donc il pourra former 1
liaison covalente.
·
L’atome d’oxygène : (K)2 (L)6, il
doit acquérir 2 électrons pour obtenir la structure stable en octet, donc il
pourra former 2 liaisons covalentes.
·
L’atome de carbone : (K)2 (L)4, il
doit acquérir 4 électrons pour obtenir la structure stable en octet, donc il
pourra former 4 liaisons covalentes.
REPRESENTATION
DE LEWIS DES MOLECULES :
Définitions :
·
Doublets
liants et non liants :
Un doublet liant est constitué de deux électrons
mis en commun dans une liaison covalente. Un
doublet non liant est formé de deux électrons de la couche externe qui
ne sont pas engagés dans une liaison covalente. Ils n’appartiennent qu’à un
seul atome.
·
Représentation de Lewis :
Elle permet de représenter les doublets liants et
non liants d’une molécule. Les doublets liants se représentent par un trait
entre les symboles des atomes et les doublets non liants se représentent par un
trait à côté du symbole de cet atome.
Etablir
une représentation de Lewis :
Méthode : Exemple :
·
Ecrire
le nom et la formule brute de la molécule. Dioxyde
de carbone : CO2
·
Ecrire
la configuration électronique de chaque atome. C : (K)2 (L)4 O :
(K)2 (L)6
En déduire le nombre ne d’électrons
externes des atomes mis en jeu.
ne (C)=4 ne (O)=6
·
En
déduire le nombre nl de liaisons covalentes que doit établir l’atome
pour acquérir une structure en octet ou en duet. nl (C)=8-4=4 nl
(O)=8-6=2
·
Calculer
le nombre total nt d’électrons externes de la molécule. nt = (1x4)+(2x6)=16
En déduire le nombre nd de doublets
externes. nd
= 16/2=8
·
![]() Répartir les doublets de la
molécule en doublets liants et non liants en respectant les règles du duet et
de l’octet.
Répartir les doublets de la
molécule en doublets liants et non liants en respectant les règles du duet et
de l’octet.
Représentation de Lewis de
la molécule CO2
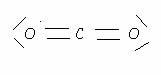
II) Représentation de Lewis de quelques atomes
|
Nom
de l’atome |
structure
électronique |
représentation
de Lewis |
nombre
de liaison covalente à réaliser |
|
hydrogène (H) |
|
|
|
|
chlore (Cl) |
|
|
|
|
azote (N) |
|
|
|
|
carbone (C) |
|
|
|
|
oxygène (0) |
|
|
|
III)
Construction de quelques molécules
Construire
les molécules avec la boite de modèle moléculaire et compléter le tableau
suivant
|
Nom
et symbole de
la molécule |
Représentation
de Lewis de la molécule |
Modèle
éclaté de la molécule |
Représentation
de Cram de la molécule et nom de la structure géométrique |
|
Dihydrogène H2 |
|
|
|
|
Dichlore Cl2 |
|
|
|
|
Chlorure
d’hydrogène HCl |
|
|
|
|
Diazote N2 |
|
|
|
|
Méthane CH4 |
|
|
|
|
Ammoniac NH3 |
|
|
|
|
Ethyne
ou acéthylène C2H2 |
|
|
|
|
Ethène
ou éthylène C2H4 |
|
|
|
|
Ethane C2H6 |
|
|
|
|
Dioxyde
de carbone CO2 |
|
|
|