TP. synthèse du
paracétamol (Par Mme feknous Lycée
Périer).
1. Principe :
Le
paracétamol est préparé à partir d’un
composé de structure proche, le paraminophénol, sur lequel on
fait réagir de
l’anhydride
éthanoïque (couramment appelé anhydride acétique).
L’équation de la réaction est :
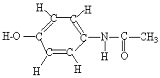
C4H6O3 + C6H7NO → C8H9NO2 + C2H4O2 .A partir de l’énoncé et de la molécule de paracétamol représentée ci-contre, donner les formules brutes de toutes les molécules citées.
2. Consignes de sécurité : Quel(s)
pictogrammes de sécurité figurent
sur le flacon
l’anhydride éthanoïque.
Quelles précautions devez-vous prendre et pourquoi ?
Dissolution du paraminophénol
Mettre
en place un bain marie à environ 80°C.
Dans un
erlenmeyer introduire : - 1,4 g de
paraminophénol
- 10mL d’eau

- 4mL
d’acide éthanoïque pur (trouvé sous la hotte).
Ajouter
un barreau aimanté. Adapter un réfrigérant à air.
Placer l’ensemble
dans le
bain-marie. Mettre le système d’agitation en route. Chauffer dix
minutes et s’assurer que la dissolution est complète
Avant
d’arrêter. Recopier et légender le schéma ci-contre.
Refroidir
l’erlenmeyer surmonté du
réfrigérant dans un bain de glace
pour amener la solution à température ambiante.
Enlever
le réfrigérant.
Obtention du paracétamol
Sous la
hotte, avec gants et lunettes, ajouter
avec précaution et
lentement 2mL
d’anhydride éthanoïque pur contenu dans une burette. Replacer
le réfrigérant sur l’erlenmeyer
et le placer dans le bain marie environ 5 minutes ( sans système
d’agitation).
Placer
ensuite l’erlenmeyer dans de l’eau
glacée. Avec un agitateur
en
verre favoriser la précipitation en grattant sur le bord de l’erlenmeyer.
Des
cristaux blancs apparaissent ; c’est du paracétamol.
Filtrer
sous pression réduite et rincer le résidu obtenu à
l’eau froide
(voir
livre p326). la masse du composé obtenu.
4.
Caractérisation du paracétamol .
Réaliser une chromatographie sur couche mince afin de caractériser le produit obtenu ;
Faire deux dépôts (une goutte), le produit
obtenu et le

paracétamol
pur sur la plaque de chromatographie en les diluant
dans un
mélange de dichlorométhane à 60%
et éthanol à 40%.
Déposer
les plaques dans le bain contenant un mélange de 60%
de dichlorométhane et 40 % d’éthanol.
Révéler les tâches à la lampe UV et
comparer
les deux tâches obtenues.
Ø Exploitation
1.
Pourquoi chauffe t- on le mélange ( paraminophénol+eau+ acide
éthanoïque) au début de la manipulation ?
2. Quel
est l’intérêt d’un réfrigérant à
air ? Quel autre type de réfrigérant peut-on utiliser au
laboratoire de
chimie
?
3.
Pourquoi refroidit-on le mélange réactionnel à la fin de
la manipulation.
4.
Faire un schéma soigné du dispositif utilisé pour
réaliser la filtration sous pression réduite.
5.
Comparer les masses de solide obtenues par les différents groupes.
Sont-elles identiques ? Si non, comment
expliquer
ces écarts ?
6.
Comparer les tâches et conclure.