transformation chimique : effets thermiques (Mr Augier ,
Lycée Périer)
Les réactions chimiques s’accompagnent d’effets thermiques, c'est-à-dire qu’elles échangent de l’énergie avec l’extérieur : nous pouvons ressentir une variation de température
I.
 Combustion du Méthane
Combustion du Méthane
Le méthane est le gaz qui brûle lorsqu’on utilise une plaque de cuisson « à gaz »
1. Qu’est ce qu’une combustion ?
2.
Quelle est la formule chimique du
méthane ?
3.
Quels sont les réactifs et les produits ?
4.
Ecrire la formule de la réaction chimique de la
combustion du méthane.
5.
Proposer un protocole pour mettre en évidence
expérimentalement les produits formés.
II.
Dissolution de composés
solides
Livre p 261 , expérience A.
III. Détermination
de la valeur énergétique d’un fruit sec
Les fruits secs ont des qualités
nutritionnelles intéressantes : ils apportent vitamines, acides
gras essentiels, oligoéléments, etc. Il faut cependant les
consommer avec modération car leur valeur énergétique est
élevée.


Comment retrouver expérimentalement la valeur énergétique d’un fruit sec ? Indications :
Extrait de la définition de la calorie donnée par le dictionnaire Le Robert : « Ancienne unité de mesure de la quantité de chaleur valant 4,184 joules ».
Extrait de la définition de la calorie donnée par le dictionnaire Larousse : « Unité de quantité de chaleur équivalant à la quantité de chaleur nécessaire pour élever d’1°C la température d’un gramme […] d’eau […] ».
Tableau des valeurs énergétiques de quelques
fruits secs :
|
Aliment |
Calories (kcal / 100g) |
joules (kJ / 100g) |
|
Amande sèche |
620 |
2592 |
|
Arachide grillée |
636 |
2658 |
|
656 |
2743 |
|
|
677 |
2830 |
|
|
612 |
2558 |
|
|
670 |
2801 |
|
|
Pistache fraîche |
638 |
2667 |
Détermination
expérimentale de la valeur énergétique d’un fruit
sec
Protocole expérimental (calorimétrie)
Protocole :
1. Déterminer la masse mcanette d’une canette en aluminium vide.
2.
La remplir d’environ
3.
Déterminer la masse m canette + eau de la canette et son contenu.
4.
Mesurer la température initiale de l’eau
Ti.
5.
Préparer le montage (voir schéma). Au
besoin, coller le bouchon avec un peu de cire.
6.
Déterminer la masse m du fruit sec avec
précision.
7.
Planter le fruit sec dans l’aiguille (attention,
risque de blessure).
8. Fabriquer et placer la cheminée :
9.
Rouler une feuille de papier A4, la scotcher et faire
trois trous dans le bas de la cheminée.
10.
La placer sur le dispositif (voir schéma).
11. Soulever la cheminée et enflammer le fruit sec à l’aide d’une allumette.
12.
Replacer délicatement la cheminée
(attention, risque d’inflammation de la cheminée).
13.
Attendre que le fruit sec soit totalement
consumé (environ 5 minutes).
14.
Remuer l’eau et mesurer la température Tf
du mélange final.
15.
Déterminer la masse m’ du résidu
de fruit brûlé.
Dispositif :

Exploitation des
résultats :
Tableau des résultats de mesures :
|
Fruit sec |
mcanette |
m canette + eau |
meau |
Ti |
Tf |
m |
m’ |
Δm = m – m’ |
E |
Ecart relatif |
|
g |
g |
g |
°C |
°C |
g |
g |
g |
kJ/100g |
||
|
|
|
|
|
|
|
|
|
|
|
|
Informations :
Il faut apporter une calorie (cal) à un gramme d’eau pour élever sa température d’un degré Celsius. Equivalence : 1 cal = 4,184 J
L’énergie libérée par la combustion de la masse Δm de fruit sec est reçue par l’eau (sous forme de chaleur) ; sa température augmente.
La chaleur Q reçue par l’eau est liée à la masse de l’eau, à la variation de la température et à un coefficient C par la relation : Q = meau´Ceau´ (Tf - Ti)
Avec la « chaleur massique de l’eau » Ceau = 4,184 J.C-1.g-1.
Remarque : une
partie de l’énergie libérée par la combustion est
reçue par l’aluminium (canette) et par l’air. Pour
simplifier les calculs, on ne tiendra pas compte de ces facteurs.
L’énergie E
libérée par la combustion de
![]() (kJ/100g)
(kJ/100g)
L’écart relatif entre la valeur attendue et la valeur expérimentale se calcule par la relation :
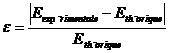
Le résultat est exprimé en pourcentage.