Travaux Pratique :
SPECTRES
et MESSAGE DE LA LUMIERE
OBJECTIFS ::
- Distinguer
un spectre dιmission dun spectre dabsorption.
- Reconnaξtre
et interprιter un spectre dιmission dorigine thermique
- Savoir
quun ιlιment chimique ne peut absorber que les radiations quil est capable
dιmettre.
- Reconnaξtre
une entitι chimique ΰ partir dun spectre.
En 1666, Isaac
Newton interprθte la lumiθre du Soleil comme la superposition de radiations de
diffιrentes couleurs. Un siθcle et demi plus tard, les astronomes dιcouvrent
que le spectre de la lumiθre solaire
est en fait plus complexe.
1.
ACTIVITE PREPARATOIRE :
ETUDE DE TEXTE : Dans lUnivers,
tout brille !
Etroite vision que celle de lHomme
ayant comme seul attribut son il nu ; pour apprιhender le monde. Il ne peut
compter que sur la lumiθre des ιtoiles. Que le Soleil disparaisse, et Terre et
ciel sombreront dans le noir. Cest pourquoi, trθs tτt, on exploita
lincandescence.
Chauffι convenablement, le
bois prend feu et la flamme qui en rιsulte crιe un halo de lumiθre. Des siθcles
plus tard, cest le filament dune lampe portιe ΰ incandescence qui ιclaire la
nuit. Les ιtoiles ιmettent de la lumiθre visible et, ΰ lil nu, on peut mκme
distinguer la lueur rouge de Bιtelgueuse (une ιtoile dont la tempιrature de surface
est de lordre de
PHOTOS CONSTELLATION
ORION
http://planet-terre.ens-lyon.fr/planetterre/objets/Images/rotation/orion1.jpg
1. Quelles
sont les sources de lumiθre citιes dans le texte ?
2. A
partir du texte quelle hypothθse pouvez-vous ιmettre pour expliquer les couleurs
diffιrentes des rayons lumineux ιmis par les ιtoiles ?
2. APPROCHE EXPERIMENTALE :
Les spectres seront visualisιs grβce ΰ
un spectroscope ΰ rιseau. Un rιseau a le mκme effet dispersif sur la lumiθre
que le prisme vu en cours.
I-
Etude du spectre dune lampe ΰ incandescence.
Viser le filament de la lampe ΰ incandescence ΰ laide dun spectroscope.
Observations :
Expιrience : Observez le spectre quand la lumiθre est trθs faible. Quelles sont les couleurs qui ont disparu dans le spectre ?
Conclusion :
Fortement chauffι un corps solide, liquide ou gazeux ιmet un rayonnement
dont le spectre est
. : cest un SPECTRE DEMISSION CONTINU.
La relation entre le spectre d continu et la tempιrature du corps ne dιpend
pas du corps.
Quand la tempιrature du corps augmente le spectre se dιplace vers les
radiations dιmission de couleurs
..
et de longueurs dondes
Application : Les ιtoiles ont des couleurs. Parmi elles, certaines sont plutτt rouges, dautres plutτt bleutιes. Quelles sont celles qui ont la tempιrature de surface la plus ιlevιe ? la moins ιlevιe ?
II- Etude de spectres de gaz excitιs
1. Lampes spectrales
Observer ΰ laide de spectroscope ΰ rιseaux et comparer les lumiθres ιmises par les diffιrentes lampes spectrales posιes sur le bureau du professeur.
Dιcrire et reprιsenter prιcisιment les spectres de ces lampes en remplissant le tableau ci-dessous :
|
Nom de la lampe |
Couleur de la lumiθre ιmise |
Spectre dιmission de cette lampe |
|||
|
Lampe ΰ vapeur de sodium |
|
|
|||
|
Lampe ΰ vapeur de mercure |
|
|
2. Observation du spectre dιmission des lampes ΰ tubes nιons de la salle.
Observer ΰ laide de spectroscope ΰ rιseau les lumiθres ιmises par les nιons ιclairant la salle de Travaux Pratiques.
1. Quel type de spectre
observez-vous ?
2.A partir de vos
observations, dιduire le fonctionnement dun tube nιon.
Conclusion :
Un gaz chaud ΰ basse pression ιmet des rayonnements dont le spectre
nest pas
: cest un SPECTRES DE RAIES.
Ce sont des radiations monochromatiques caractιristiques de la nature
du gaz.
Le spectre
. est une signature dune espθce chimique.
III Observations de
spectres dabsorption
1.
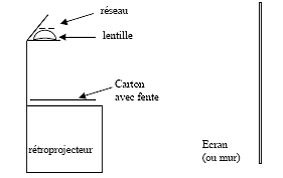
Absorption de la lumiθre par un filtre :
|
A laide du montage utilisant le
rιtroprojecteur, on visualise le spectre de la lumiθre blanche. Ensuite, on place sur la fente du
carton, lun aprθs lautre, plusieurs filtres colorιs. On dessine les
spectres obtenus. |
|
|
Spectre de la lumiθre blanche |
|
|
Avec filtre bleu |
|
|
Avec filtre jaune |
|
|
Avec filtre rouge |
|
|
Avec filtre vert |
|
On en dιduit que :
|
Le filtre bleu absorbe
. |
|
Le filtre jaune absorbe
. |
|
Le filtre rouge absorbe
. |
|
Le filtre vert absorbe
. |
2.
Absorption de la lumiθre par une
solution colorιe
A laide du montage ci-dessous, on observe le spectre dabsorption de
diffιrentes solutions colorιes.
 Fente
Fente
Source
Solution Rιseau Ecran
blanche colorιe
Rιsultats :
|
Nom de la solution |
Couleur de la solution |
Spectre de la lumiθre |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Conclusion :
Le spectre de la lumiθre qui a traversι
une solution colorιe prιsente des
..
sur un fond
. : cest un SPECTRE DE BANDES
DABSORPTION.
Le spectre dabsorption dune solution
de permanganate de potassium prιsente une bande noire dans les couleurs
: la solution
.. donc ces couleurs.
Une solution colorιe absorbe une partie
des couleurs de la lumiθre
.. La couleur de la solution rιsulte de la somme
des couleurs
..
Le spectre dabsorption obtenu est caractιristique de
.
Un gaz chaud ΰ faible pression ιclairι
en lumiθre blanche prιsente aussi un spectre de raies dabsorption
complιmentaire au spectre de raies dιmission.
3. INITIATION A
LASTROPHYSIQUE :
I.
QUESTIONNEMENT :
1) Pourquoi ne peut-on pas effectuer une
ιtude in situ de la composition du Soleil en envoyant une sonde par
exemple ?
2) Quelle est alors la seule solution
possible pour les astrophysiciens ?
3) Expliquer quel type de spectre on
obtient en dιcomposant la lumiθre du Soleil et quel modθle simple permet
dinterprιter lobtention de ce type de spectre :
II.
DEMARCHE EXPERIMENTALE :
1)
A laide de ce premier lien, dιterminer
les raies des atomes dHydrogθne, de Carbone et dHιlium.
http://www.ostralo.net/3_animations/swf/spectres_abs_em.swf
|
ιlιments |
Longueur donde des raies (nm) |
|||||||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
He |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
2)
A laide de ce second lien, dιterminer
les longueurs dondes des raies dabsorption du spectre du soleil.
http://www.ostralo.net/3_animations/swf/spectres_soleil.swf
|
Longueur donde des raies (nm) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3)
Identifier les ιlιments chimiques
correspondant ΰ ces raies, ainsi que leur localisation (atmosphθre terrestre ou
stellaire ?)
FICHE TP :
MATERIEL : SPECTRES
et MESSAGE DE LA LUMIERE
Paillasse ιlθve :
Spectroscopes portables.
Poste informatique + rιseau.
Paillasse professeur :
- Lampes spectrales (Hg, Na).
- Poster des spectres d'ιmission.
- Gιnιrateur, rhιostat, lampe ΰ incandescence, fils de connexion
- Montage d'absorption dune solution colorιe (prisme ou rιseau, lentille, source, ιcran, cuve) avec des solutions de permanganate de potassium concentrι et de sulfate de cuivre concentrιe.
- Rιtroprojecteur + rιseau + fente en carton souple + filtre plastique rouge, jaune, verte, bleu. + ιcran