T.P. 10 Les piles
Objectifs
¤ déterminer le
sens spontané de différentes réactions mettant en jeu deux couples ox / red du
type cation métallique / métal (Mn+(aq) / M(s)),
¤ classer les
métaux selon leur pouvoir réducteur,
¤ réalisation de
quelques piles.
I ] Etude préalable de réactions
d’oxydoréduction
1)
Etude de la transformation mettant en jeu les couples Cu2+(aq) /
Cu(s) et Fe2+(aq) / Fe(s)
Dans un bécher contenant environ 50 mL d’une
solution de sulfate de fer (II), immerger une lame de cuivre. Noter vos
observations.
Dans un bécher contenant environ 50 mL d’une
sulfate de cuivre (II), ajouter environ 4,0 g de limaille de fer. Agiter
jusqu’à observer la décoloration de la solution. Noter l’aspect du solide en
suspension.
2)
Etude de la transformation mettant en jeu les couples Cu2+(aq) /
Cu(s) et Zn2+(aq) / Zn(s)
Dans un bécher contenant environ 50 mL d’une
solution de sulfate de zinc, immerger une lame de cuivre. Noter vos
observations.
Dans un bécher contenant environ 50 mL d’une
sulfate de cuivre (II), ajouter environ 4,0 g de limaille de zinc. Agiter
jusqu’à observer la décoloration de la solution. Noter l’aspect du solide en
suspension.
3) Etude de la
transformation mettant en jeu les couples Fe2+(aq) / Fe(s) et Zn2+(aq)
/ Zn(s)
Dans un bécher contenant environ 50 mL d’une
solution de sulfate de fer (II), immerger une lame de zinc. Agiter. Noter vos
observations.
Dans un bécher contenant environ 50 mL d’une
sulfate de zinc, ajouter environ 4,0 g de limaille de fer. Agiter.
Noter vos observations.
4) Questions
1)
A l’aide des observations relevées,
indiquer dans quel cas on observe effectivement une transformation chimique
lors de ces trois manipulations.
2)
Ecrire les équations de ces transformations
et préciser le sens spontané d’évolution des systèmes chimiques correspondants.
3)
Lorsque la transformation mettant en jeu
des couples ox / red s’effectue spontanément dans le sens :
![]() n2 ox1
+ n1 red2 n2
red1 + n1 ox2 ; on convient de dire que l’oxydant ox1 est plus fort
(ou a un pouvoir oxydant plus grand) que l’oxydant ox2 et que le
réducteur red2 est plus fort (ou a un pouvoir réducteur plus fort)
que le réducteur red1. Classer les différents couples étudiés selon
leur pouvoir oxydant décroissant de leur cation métallique (ou selon le pouvoir
réducteur croissant de leur métal).
n2 ox1
+ n1 red2 n2
red1 + n1 ox2 ; on convient de dire que l’oxydant ox1 est plus fort
(ou a un pouvoir oxydant plus grand) que l’oxydant ox2 et que le
réducteur red2 est plus fort (ou a un pouvoir réducteur plus fort)
que le réducteur red1. Classer les différents couples étudiés selon
leur pouvoir oxydant décroissant de leur cation métallique (ou selon le pouvoir
réducteur croissant de leur métal).
II ] Etude de quelques piles
électrochimiques
1)
Réalisation de quelques
piles électrochimiques

![]()
![]()
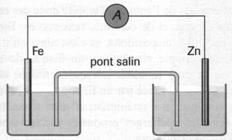
Fe2+ Zn2+
Placer ensuite le multimètre en position voltmètre
(attention aux branchements) et relever la tension aux bornes de la pile ainsi
constituée, appelée force électromotrice de la pile notée E.
2)
Questions
Pour chaque pile, suivre la démarche
suivante :
1)
Faire un schéma du montage.
2)
Y indiquer la polarité de la pile et le
sens de déplacement de tous les porteurs de charge.
3)
Ecrire les équations des réactions aux
électrodes et l’équation de la réaction globale de fonctionnement de la pile.
4)
Réaliser le schéma conventionnel de la
pile.