|
Observer: ondes et matière |
Chapitre 4 : analyse spectrale
|
|||||||
|
Animation: représentation spatiale des molécules l'animation wikipédia sur les différentes vibration du groupe CH2. animation du spectre
infrarouge du méthanal (en anglais). Cours écrit |
|
Programme officiel
Observer
Ondes
et matière Les
ondes et les particules sont supports d’informations. Comment
les détecte-t-on ? Quelles sont les caractéristiques et les propriétés des
ondes ? Comment
réaliser et exploiter des spectres pour identifier des atomes et des
molécules ?
|
||||||
Introduction: La matière interagit avec les ondes électromagnétiques. La spectroscopie est l'étude quantitative des interactions entre la lumière et la matière. Elle permet de déterminer la nature et la concentration d'espèces chimiques présentes dans un échantillon de matière.
I) Spectroscopie
UV-visible
1)
principe de fonctionnement d'un spectroscope
Animation: le spectrophotomètre (ostralo.net). Utiliser le spectrophotomètre en faisant varier les différents paramètres de l'animation. Comment évolue l'absorbance en fonction de la longueur d'onde puis de la concentration pour une solution de permanganate de potassium?

Un spectrophotomètre UV-visible est constitué de:
- une source de lumière blanche
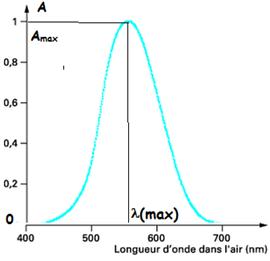
- un monochromateur permettant de sélectionner une radiation monochromatique de longueur d'onde précise (sur le schéma la longueur d'onde vaut 551 nm)
- un séparateur de faisceau. En sortie du séparateur, un faisceau traverse la cuve contenant le solvant (généralement de l'eau distillée), un second faisceau traverse la solution à analyser.
- la comparaison des 2 faisceaux d'intensités respectives I (la solution) et Io (le solvant) permet de calculer l'absorbance A de l'échantillon.
- la courbe
qui représente l'absorbance en fonction de la longueur d'onde ![]() est appelée spectre de l'échantillon.
est appelée spectre de l'échantillon.
Vidéo de TP au laboratoire: absorbance en fonction de la longueur d'onde
2) loi de Beer Lambert
Vidéo de TP au laboratoire: loi de Beer Lambert
l'absorbance d'une
solution colorée A(l) est égale à :
 : coefficient d'absorption molaire qui dépend du solvant de
la température et de la longueur d'onde
: coefficient d'absorption molaire qui dépend du solvant de
la température et de la longueur d'onde
unité légale: m-1.
mol-1.L
L(m): épaisseur de solution traversée
C (mol.m-3) :
concentration de la solution.
A est sans unité
Remarque :
Si l'absorbance est trop grande cette loi n'est plus valable il faut diluer la solution.
Une espèce chimique est caractérisée en spectroscopie
UV-visible par la longueur d'onde du
maximum d'absorption ![]() et par la valeur du coefficient d'extinction molaire
et par la valeur du coefficient d'extinction molaire ![]() correspondante.
correspondante.
2) couleur et absorbance d'une solution colorée
Une substance incolore
comme l'eau n'absorbe aucune radiation visible: son absorbance est nulle quelque
soit  .
.
La couleur d'une
espèce est la somme des couleurs complémentaires des radiations qu'elle
absorbe.
Le cercle chromatique
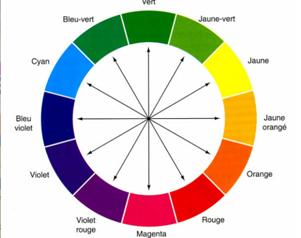
Exemple: le spectre d'absorption du dichromate de potassium (compris entre 400 et 600 nm) est le suivant:
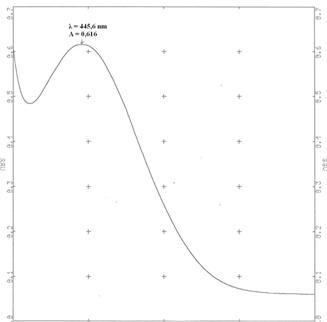
Il absorbe les radiations violettes, bleues et une partie des radiations vertes. Sa couleur est donc la somme des couleurs complémentaires qui sont (d'après le cercle chromatique) le jaune orangé, l'orange et le rouge. La solution à en effet une couleur orangée. Solution de dichromate de potassium (2K+,Cr2O72-):

II) Nomenclature des composés organiques
1)
groupe
caractéristique et fonction
Un composé organique provient d'une espèce vivante. Il contient une chaine carbonée et un ou plusieurs groupes caractéristiques. Les molécules possédant le même groupe caractéristique ont des propriétés chimiques similaires Ces propriétés définissent la fonction chimique.
animation: représentation spatiale des molécules
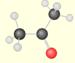
Voici quelques composés organiques oxygénés:
|
fonction |
groupe caractéristique |
exemple |
|
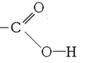
acide carboxylique |
groupe carboxyle
|
acide éthanoïque (présent dans le vinaigre) |
|
alcool |
groupe hydroxyle
|
éthanol (présent dans le vin) |
|
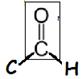
aldéhyde |
groupe carbonyle (encadré)
|
éthanal (produit par les plantes) |
|
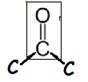
cétone |
groupe carbonyle
|
propanone (produit par les plantes) |
|
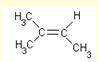
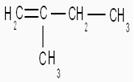
alcène |
alcène
|
2-méthylbut-2-ène
|
|
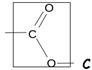
Ester |
ester (encadrée)
|
méthanoate de méthyle
|
|
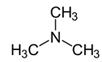
Amine |
amine
|
la triméthylamine |
|
Amide |
amide
|
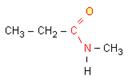
N-méthylpropanamide
|
2) rappel sur le
nom des 5 premiers alcanes à chaine linéaire
Les alcanes à chaine linéaire sont constitués à partir de carbone tétragonal (lié à 4 autres atomes) et d'atomes d'hydrogène. Leur formule brute générale est CnH2n+2. Leur nom doit être connu car on va utiliser le préfixe pour nommer les composés oxygénés.
maman est partie bébé pleure
méthane éthane propane butane pentane
|
Nom |
Nombre d’atomes de carbone |
Formule brute |
formule et nom du groupement alkyle correspondant |
|
1 |
CH4 |
CH3- méthyl |
|
|
2 |
C2H6 |
CH3-CH2- éthyl |
|
|
3 |
C3H8 |
CH3-CH2-CH2- propyl |
|
|
4 |
C4H10 |
CH3-CH2-CH2-CH2- butyl |
|
|
5 |
C5H12 |
CH3-CH2-CH2-CH2-CH2- penthyl |
3) règles de
nomenclature
a) acides carboxyliques
Pour établir le nom
des acides carboxyliques
1. on recherche la
chaîne la plus longue comportant l'atome de carbone fonctionnel
2. on numérote les
atomes de carbone en minimisant l'indice du carbone fonctionnel
3. on repère les
ramifications alkyle sur la chaîne principale, on écrit le numéro du carbone portant
la ramification, puis un tiret et enfin le nom de la ramification avant le nom
de la chaîne principale.
4. Le nom du
composé est précédé du mot acide. On remplace ensuite le 'e' du nom de l'alcane
correspondant par la terminaison 'oïque'.
Exemple:
|
nom |
formule développée ou semi-développée |
|
acide méthanoïque (présent dans les venins de certains insectes, fourmi |
|
|
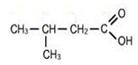
acide 3-methylbutanoïque (présent dans l'urine de chat, qui sert de marqueur de territoire!) |
|
|
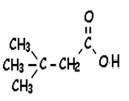
acide 2-méthylpropanoïque (présent dans certains arbres comme le caroubier |
|
|
acide 3,3-dimethylbutanoïque |
|
b) alcools
Les règles sont
identiques à celles des acides carboxyliques. On remplace ensuite le
"e" du nom de l'alcane correspondant par la terminaison 'ol'.
Exemple:
|
nom |
modèle éclaté |
|
pentan-2-ol |
|
|
2-methylpentan-2-ol |
|
|
méthanol |
|
c) aldéhydes et cétones
Les règles sont
identiques à celles des acides carboxyliques. On remplace ensuite le
"e" du nom de l'alcane correspondant par la terminaison 'al' pour les
aldéhydes et 'one' pour les cétones.
Exemples:
|
formule semi-développée |
nom |
|
|
pentan-3-one |
|
|
2-méthylbutanal |
|
|
3-méthylbutan-2-one |
|
|
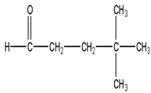
4,4-diméthylpentanal |
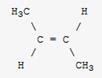
d) alcènes
Les règles sont identiques
à celles des acides carboxyliques. On remplace ensuite le "e" du nom
de l'alcane correspondant par la terminaison 'ène'.
On rajoute (Z) ou (E) suivi d'un tiret lorsqu'une isomérie Z ou E existe dans
la molécule
Exemple:
|
formule semi-développée |
nom |
|
|
(Z)-pent-2-ène |
|
|
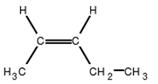
(E)-but-2-ène |
|
|
prop-1-ène |
|
|
pent-1-ène |
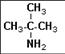
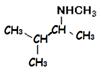
e) les amines
Les règles sont
identiques à celles des acides carboxyliques. On remplace ensuite le
"e" du nom de l'alcane correspondant par la terminaison 'amine'.
Lorsque l'atome d'azote est lié à d'autres groupes alkyle, le nom de l'amine
est précédé de la mention N-alkyl. Si il y a 2 groupes alkyle, le nom est
précédé de la mention N,N-alkyl.
Exemple:
|
formule semi-développée |
nom |
|
|
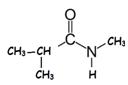
2-methylpropan-2-amine |
|
CH3-NH-CH3 |
N-méthylmethanamine |
|
|
N-méthylpentan-3-amine |
|
|
N,3-diméthylbutan-2-amine |
f) les amines
Les règles sont
identiques à celles des acides carboxyliques. On remplace ensuite le
"e" du nom de l'alcane correspondant par la terminaison 'amide'.
Lorsque l'atome d'azote est lié à d'autres groupes alkyle, le nom de l'amine
est précédé de la mention N-alkyl. Si il y a 2 groupes alkyle, le nom est
précédé de la mention N,N-alkyl.
Exemple:
|
formule semi-développée |
nom |
|
|
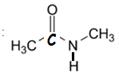
N-methyléthanamide |
|
|
N,2-diméthylpropanamide |
|
|
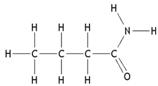
butanamide |
III) spectroscopie
infrarouge
Photo d'un spectroscope à infrarouge
1) définition
La spectroscopie
infrarouge (IR) est dans son
principe identique à la spectroscopie UV-visible. Le domaine de longueur d'onde
utilisé est (2500 nm, 25000 nm). Les
OEM interagissent avec les liaisons
covalentes de la molécule. Pour cette raison la spectroscopie IR permet de
repérer la présence de certaines liaisons et d'en déduire les groupes caractéristiques présents dans la molécule.
2) le spectre IR
d'une molécule
Le nombre d'onde 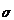 d'une OEM est égale à l'inverse de sa longueur d'onde
d'une OEM est égale à l'inverse de sa longueur d'onde 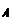 :
:

La transmittance T
est égale au rapport de l'intensité transmise I à travers la substance à
analyser sur l'intensité Io transmise par le solvant. La transmittance n'a pas
d'unité, sa valeur est comprise entre 0 et 1.
![]()
Le spectre IR d'une
espèce chimique représente la transmittance T en ordonnée en fonction du nombre
d'onde 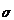 en abscisse. Généralement le nombre d'onde est exprimé en
cm-1.
en abscisse. Généralement le nombre d'onde est exprimé en
cm-1.
une transmittance de 100 % indique que l'IR n'est pas absorbé. Lorsqu'un IR ou une bande d'IR est absorbé alors on observe un pic ou une bande d'absorption (transmittance faible) orienté vers le bas.
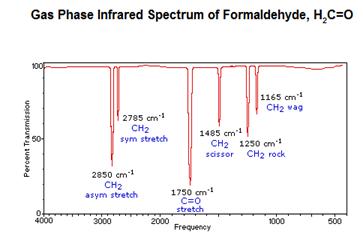
Exemple: animation du spectre infrarouge du méthanal (en anglais).
Le spectre IR du méthanal possède plusieurs pics d'absorption:
- 5 pics correspondant à la liaison entre le carbone et les 2 hydrogène (notée CH2 sur le spectre)
- un pic correspondant à la double liaison entre le carbone et l'oxygène.
Ce spectre permet d'affirmer que l'espèce analysée et le premier aldéhyde : le méthanal. Sur le graphique sont indiqués les nombres d'onde correspondant aux absorptions les plus importantes donc aux transmittances les plus faibles .
3) Pourquoi l'espèce chimique absorbe les IR?
Les atomes de la molécule peuvent se déplacer dans toutes les directions. Par exemple les atomes du groupe CH2 peut vibrer de 6 manières différentes : étirements (stretching),symétrique et anti symétrique, cisaillement (scissoring), bascule (rocking), agitation hors du plan (wagging) et torsion (twisting). Voir l'animation wikipédia.

A chaque vibration correspond une énergie En. Lorsque les IR correspondant à cette énergie interagissent avec l'espèce chimique, ils sont absorbés, leur transmittance est alors faible.
4) bandes d'absorption caractéristiques
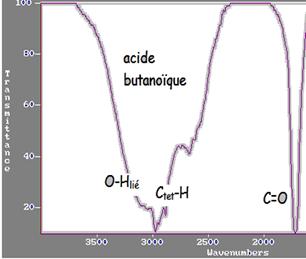
On appelle une liaison chimique O-Hlié lorsqu'il existe des liaisons hydrogène et OHlibre lorsqu'il n'y a pas de liaison hydrogène.
Les nombres d'ondes utile à la recherche des groupes caractéristiques sont supérieurs à 1500 cm-1 ( à part quelques exceptions comme pour la liaison C-O, voir tableau ci dessous). Ceux inférieurs à 1500 cm-1 ne sont utiles que pour comparer les spectres.
Méthode pour analyser un spectre IR:
- repérer les liaisons chimiques ( C-H, N-H, C=O etc..) grâce à leurs nombres d'onde. attention à une liaison peut correspondre plusieurs bandes d'absorption car la liaison peut vibrer de différentes façons (symétrique, cisaillement etc..)
- rechercher les groupes caractéristiques ( hydroxyle OH, carboxyle -COOH etc..) possédant ces liaisons. Attention certaines liaisons appartiennent à plusieurs groupes. Par exemple la liaison C=O appartient aux groupes carboxyle et carbonyle.
- vérifier que toutes les bandes caractéristiques des groupes retenus se trouvent dans le spectre IR
- utiliser éventuellement les valeurs précises des nombres d'onde pour départager les groupes.
Tableaux de quelques bandes d'absorption avec l'intensité correspondante de l'absorption (F: forte, M: moyen)
|
liaison |
nombre d'onde (cm-1) |
intensité |
|
O-Hlibre |
3580 à 3650 |
F, fine |
|
O-Hlié |
3200 à 3400 |
F, large |
|
N-H |
3100 à 3500 |
M |
|
Ctri-H (carbone trigonal) |
3000 à 3100 |
M |
|
Ctet-H (carbone tétragonal) |
2800 à 3000 |
F |
|
C=Oester |
1700 à 1740 |
F |
|
C=Oaldehyde_cétone |
1650 à 1730 |
F |
|
C=Oacide |
1680 à 1710 |
F |
|
C-C |
1625 à 1685 |
M |
|
Ctet-H |
1415 à 1470 |
F |
|
C-O |
1050 à 1450 |
F |
Plus la liaison est forte, plus le nombre d'onde 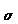 d'absorption est élevé
d'absorption est élevé
-
bandes C-H: le nombre d'onde ![]() dépend de la nature du carbone. Par exemple, le carbone tétragonal est présent
dans les alcanes par exemple dans l'éthane H3Ctet-CtetH3.
Le carbone trigonal est présent dans les alcènes H2Ctri=CtriH2.
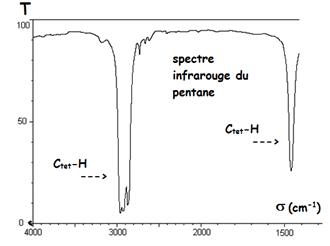
D'après le tableau ci dessus Un alcane
présentera deux bandes d'absorption due
à la liaison C-H:
dépend de la nature du carbone. Par exemple, le carbone tétragonal est présent
dans les alcanes par exemple dans l'éthane H3Ctet-CtetH3.
Le carbone trigonal est présent dans les alcènes H2Ctri=CtriH2.
D'après le tableau ci dessus Un alcane
présentera deux bandes d'absorption due
à la liaison C-H:
-entre 2800 et 3000 cm-1 d'intensité forte
- entre 1415 et 1470 cm-1 (lié à la déformation angulaire des liaisons C-H) d'intensité forte
Un alcène présentera une bande d'absorption de moyenne intensité due à la liaison C-H comprise entre 3000 et 3100 cm-1.
-
bande C=C : elle se retrouve dans les alcènes et également dans
les composés aromatiques comme le benzène ou elle est moins fortes car
délocalisée (le nombre d'onde est alors plus faible ![]() compris entre 1450 et 1600 cm-1). Voici un extrait
des spectres IR de l'hexane et de l'alcène hexène.
compris entre 1450 et 1600 cm-1). Voici un extrait
des spectres IR de l'hexane et de l'alcène hexène.
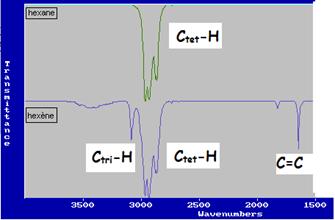
- bande C=O: la liaison C=O est présente dans les aldéhydes, cétones, esters, amides etc. ;La position de la bande d'absorption dépend du type de fonction (voir tableau). Elle se situe entre 1650 et 1740 cm-1 environ.
-
bande C-O: la liaison C-O est présente dans les acides carboxyliques, alcools etc. ;La
position de la bande d'absorption dépend du type de fonction (voir tableau). Sa
bande se situe entre 1050 et 1450 cm-1.
- bande N-H: la liaison N-H est présente dans les amines et amides etc. ;La position de la bande d'absorption dépend du type de fonction (voir tableau). Sa bande se situe entre 3100 et 3500 cm-1. Remarque, le spectre IR d'une amine RNH2 donne 2 bandes alors que celui d'une amine RNR'H ne donne qu'une bande (1 seule liaison N-H).
Exemple: spectre IR de la N-méthylamine et du cyclohexylamine
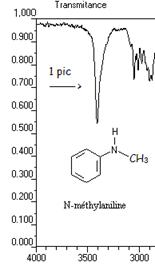
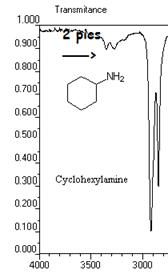
5) cas de la liaison O-H
La liaison O-H se trouve dans les alcools, les acides carboxyliques.
Dans le cas des alcools, La liaison hydrogène affaiblie la liaison O-H. Elle a tendance à la rompre. A l'état gazeux il n'existe pas de liaison hydrogène entre les molécules car elles se trouvent à de grandes distances les unes des autres. La liaison O-H est alors appelée O-Hlibre. A l'état gazeux la liaison O-Hlibre donne une bande d'absorption forte et fine vers 3620 cm-1. A l'état liquide la liaison hydrogène existe, la liaison O-H est alors notée O-Hlié. elle est affaiblie par conséquent le nombre d'onde est plus faible et la bande plus large. Elle est comprise entre 3200 et 3400 cm-1.

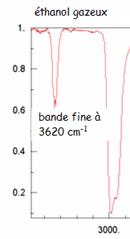
Pour les acides carboxyliques sous forme liquide, l'élargissement de la bande correspondant à la liaison O-Hlié provoque un chevauchement avec la bande d'absorption Ctet-H.
IV) spectroscopie RMN
1) Principe
La résonance magnétique nucléaire (RMN) est une technique qui permet d'identifier les atomes d'hydrogène d'une molécule ainsi que la nature et le nombre des atomes de leur environnement proche.
L'appareil émet une OEM qui interagit avec le noyau des atomes d'hydrogène donc avec le proton d'ou le nom de RMN du proton. On place un échantillon de matière dans un champ magnétique Bo. On envoie une OEM qui fait entrer en résonance le proton qui vibre à une fréquence f. En retournant à son état initial le proton émet une OEM de fréquence f qui est enregistrée puis traitée afin d'obtenir le spectre RMN. La RMN permet ainsi de distinguer dans la molécule d'éthanol CH3-CH2-OH les protons du groupe CH3 ceux du groupe CH2 et celui du groupe OH.
2) le spectre RMN
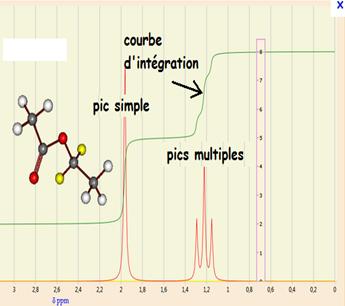
Un spectre RMN est constitué d'un ensemble de signaux, constitués d'un ou plusieurs pics fins. Chaque signal correspond à un atome ou groupe d'atomes d'hydrogène. L'environnement de l'atome ou du groupe d'atome influe sur:
- la
position du signal, repérée en abscisse par une valeur appelée le déplacement
chimique ![]() .
.
Le déplacement chimique ![]() d'un atome d'hydrogène dépend des atomes présents dans son
environnement. Son unité est le ppm (partie par million). Il dépend de la
fréquence de résonnance de l'atome d'hydrogène.
d'un atome d'hydrogène dépend des atomes présents dans son
environnement. Son unité est le ppm (partie par million). Il dépend de la
fréquence de résonnance de l'atome d'hydrogène.
- sa multiplicité (nombre de pics le composant)
Une courbe d'intégration se superpose au spectre. Elle est constituée de paliers successifs (voir le ???? pour la signification.
3) le déplacement chimique 
L'axe des déplacement chimique est orienté de droite à gauche, généralement
de 0 à 15 ppm. A un déplacement chimique nulle ![]() correspond les hydrogènes du tétraméthylsilane (TMS):
correspond les hydrogènes du tétraméthylsilane (TMS):
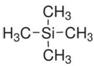
Cette substance est ajoutée à la substance à analyser. Chaque signal constitué d'un ou plusieurs pics traduit une absorption d'énergie par les protons. Ceux ci entre alors en résonnance.
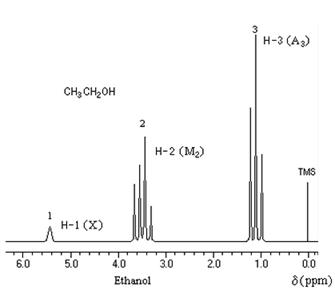
Dans l'éthanol CH3-CH2-OH les hydrogènes du groupe CH3 résonnent vers 1,2 ppm, ceux du groupe CH2 vers 3,6 ppm et celui du groupe OH vers 4,7 ppm.
Le proton du groupe carboxyle -CO2H résonne entre 8,5 et 13 ppm; celui du groupe carbonyle des aldéhydes -COH résonnent entre 9 et 10 ppm. Voir p 595 les déplacements chimiques des protons en RMN.
4) les protons équivalents
Dans le cas des molécules simples les protons sont dit équivalents (ils ne donnent qu'un seul signal sur le spectre) dans les cas suivants:
a) les protons sont portés par un même atome de carbone.
Exemple: dans la molécule de propane CH3-CH2-CH3 sont équivalents :
- les 3 atomes d'hydrogène du premier carbone
- les 2 atomes du second
- les 3 atomes du troisième
Le spectre RMN sera constitué de 3 signaux.
b) si la molécule présente une symétrie, les protons qui se correspondent sont équivalents.
Exemple:
- dans la molécule de méthoxyméthane CH3-O-CH3 il y a une symétrie tous les atomes d'hydrogène sont équivalents. Le spectre RMN ne sera constitué que d'un seul signal.
- Dans la molécule de pentan-3-one CH3-CH2-CO-CH2-CH3 , il y a une symétrie. Les 6 protons liés aux carbones situés aux extrémités sont équivalents. Les 4 protons liés aux carbones situés de part et d'autre de la liaison carbonyle sont équivalents. Le spectre RMN sera constitué de deux signaux.
5) multiplicité du signal