Chapitre
2 : suivi temporel d’une réaction chimique
étude par
spectrophotométrie et titrage(Nouvelle Calédonie novembre 2004)
1.
Suivi spectrophotométrique de la transformation chimique.
|
t
(min) |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
30 |
40 |
50 |
60 |
90 |
|
A |
0,08 |
0,13 |
0,23 |
0,31 |
0,39 |
0,45 |
0,50 |
0,55 |
0,59 |
0,62 |
0,65 |
0,74 |
0,77 |
0,79 |
0,79 |
0,79 |
1.1.
On peut également suivre la réaction par conductimétrie.
1.2.
1.2.1. Vidéo
![]()
1.2.2. Donner l’expression de la quantité
de matière n(I2)t en fonction de l’absorbance au cours du
temps de k et des volumes V1 et V2.
2I-(aq) + S2O82-(aq)
= I2(aq) + 2SO42-(aq)
La solution est colorée uniquement grâce au
diiode I2
A=k.[I2]t avec [I2]t
= n(I2)t/(V1+V2)
donc
![]()
1.2.3. Calculer la quantité de matière
de diiode formé à l’instant de date t = 14 min.
![]()
1.3. Donner une méthode qui permettrait d’obtenir plus rapidement la même quantité finale de diiode à partir du même mélange réactionnel S.
Il suffirait de chauffer le mélange pour accélérer
la réaction.
2. titrage du diiode formé après 90 minutes
de réaction.
2.1.
Représenter sur la copie le schéma du dispositif de titrage en précisant le nom
du matériel et la nature des solutions.
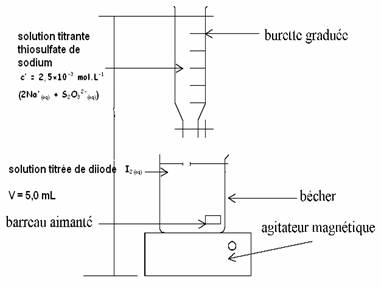
2.2.
Vidéo
A
l’équivalence les réactifs ont été introduits dans les conditions
stœchiométriques. D’après l’équation bilan :
I2(aq) + 2S2O32-(aq)
= 2 I-(aq) +
S4O62-(aq)
![]()
2.3. Exploitation du titrage.
2.3.1. Vidéo
V’E = 9,2 mL pour un volume de 5
mL l’équivalence nous donne :
![]()
Le mélange contenait 20 mL de solution donc
4 fois plus de quantité de matière de diiode que celle dosée :
n(I2)t=
90 min = (4/2).c’V’E = 2.c’V’E
2.3.2. n(I2)t=
90 min = 2.c’V’E = 2.c’V’E = 2x2,5x10-3x9,2x10-3 =
4,6x10-5 mol
2.3.3 Il suffit de regarder sur la courbe
x(t) car d’après l’équation bilan de la réaction
2I-(aq)
+ S2O82-(aq) = I2(aq) +
2SO42-(aq)
n(I2)t = x(t) = 46x10-6
mol

3.
Étude théorique et bilan comparatif.
3.1. ½ réaction de réduction (gain
d’électrons)
S2O82-
+2e- = 2SO42-
½ réaction
d’oxydation (perte d’électrons)
2I- = I2 + 2e-
équation
d’oxydoréduction
S2O82-
+ 2 I- = 2 SO42- + I2
3.2.
La transformation chimique est supposée totale.
3.2.1.
Tableau en mole
(mol)
|
Relation stœchiométrique |
2I–
(aq) + S2O82–(aq) = I2 (aq) +
2 SO42– (aq) |
||||
|
Avancement |
Quantité de matière en mol |
||||
|
État initial |
c1.V1
= 5x10-1x10-2=5x10-3 |
0 |
0 |
||
|
Au cours de la
transformation |
x |
5x10-3-2.x |
5x10-5
– x |
x |
2x |
|
État final
attendu |
xmax |
5x10-3-2.xmax |
5x10-5
– xMAX |
xMAX |
2xMAX |
3.2.2.
2 possibilités de fin de réaction :
1)
il n’ya plus d’ion iodure :
5x10-3-2.xmax
= 0
xmax
= 2,5x10-3mol
2)
il n’ya plus de peroxodisulfate
5x10-5
– xMAX = 0
xmax = 5x10-5 mol
On
prend la plus petite valeur de xmax le peroxodisulfate est en
défaut : xmax = 5x10-5
mol
n(I2)
max = xmax = 5x10-5 mol
3.3.

8% d’erreur erreur
due au spectrophotomètre ou à la concentration de l’ion peroxodisulfate
3.4 Vidéo
D’après la courbe
de l’avancement à t = 10 min, x = 26x10-6 mol

![]()