CORROSION DES GOUTTIÈRES (France métropole 2006 )
1. Suivi cinétique de la transformation
1.1 Tableau d’avancement
|
Équation chimique |
Zn
(s) + 2 H3O+ =
Zn2+ (aq) + H2 (g) +
2 H2O ( |
|||||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
||||
|
État initial |
0 |
n(Zn)i |
n(H3O+)i |
0 |
0 |
excès |
|
État en cours de transformation |
x |
n(Zn)i – x |
n(H3O+)i – 2x |
x |
x |
excès |
|
État final |
xmax |
n(Zn)i – xmax |
n(H3O+)i – 2xmax |
xmax |
xmax |
excès |
1.2. Détermination du réactif limitant :
Si le zinc est limitant alors sa quantité de matière à l’état finale est nulle :
n(Zn)i
– xmax = 0
xmax
= n(Zn)i =m(Zn)i/M(Zn)
xmax = 0,50/65,4 =7,6´10–3 mol
Si l'ion oxonium est limitant alors sa quantité de matière à l’état finale est nulle
n(H3O+)i
– 2xmax = 0, soit xmax = n(H30+)/2
= [H30+]i.V/2
![]() .
.
Le réactif limitant
est le zinc car il correspond à la valeur de l'avancement maximal la
plus faible,![]()
xmax = 7,6´10–3 mol = 7,6 mmol
1.3.1. D'après le tableau d'avancement, n(H2) = x et (P – Pi).Vgaz = n(H2).R.T donc
![]()
1.3.2. Pour P = Pmax alors x = xmax or :
![]()
en faisant le rapport de x/xmax on élimine R.T :
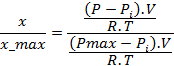
donc : x = xmax 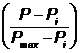
1.3.3. D’après la figure 2 : xmax =7,5 mmol
or la valeur calculée 1.2 est xmax = 7,6 mmol : les 2 valeurs sont similaires.
.
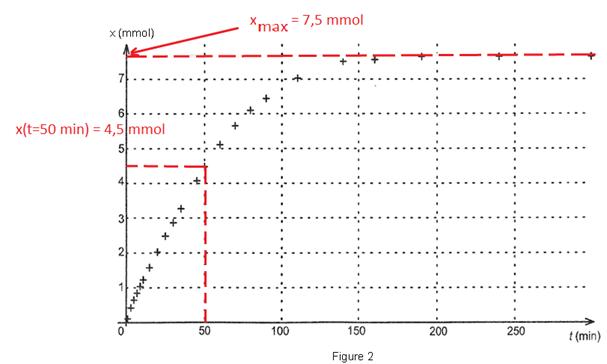 1.3.4. Pour t = 50,0 min, P = 1452
hPa et :
1.3.4. Pour t = 50,0 min, P = 1452
hPa et :
Pi = 1020hPa et Pmax = 1757 hPa.
or : x = xmax 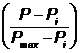
![]()
x = 4,5´10–3 mol = 4,5 mmol
Graphiquement on retrouve pour t = 50 min la valeur xmax = 4,5 mmol.
1.4.La vitesse volumique de
réaction à l’instant t est égale à la érivée de l’avancement au cours du temps
divisée par le volume V de solution :
![]() .
.
 La vitesse est proportionnelle à la dérivée
de x par rapport au temps. Or la dérivée est égale à la pente de la tangente à
la courbe à l’instant t. Cette pente diminuant au cours du temps la
vitesse diminue également.
La vitesse est proportionnelle à la dérivée
de x par rapport au temps. Or la dérivée est égale à la pente de la tangente à
la courbe à l’instant t. Cette pente diminuant au cours du temps la
vitesse diminue également.
1.5 Calcul de v(0). Soit 2 points M1 et M2 de la tangente à la courbe à t = 0 s.:
M1(t1 = 0 min ; x1 = 0 mmol) et M2(t2 = 50 min ; x2 = 7,0x10-3 mol)
La pente de la tangente à la courbe vaut :
![]()
La vitesse à l’instant t= 0 s vaut :
![]()
v(to) = 1,9x10-2
mol.L-1.min-1

2. Facteurs cinétiques
2.1. Influence de la concentration en ion oxonium
Les ions oxonium H3O+
catalyse la réaction : plus leur concentration est élevée plus la vitesse
de la réaction augmente. Or la vitesse de réaction est proportionnelle à la
pente de la tangente à la courbe
x(t) : plus la pente de la courbe est
importante plus la concentration en ions hydronium est élevé.
[H3O+]exp
1 > [H3O+]exp 3 > [H3O+]exp
2
 donc
v1 > v3 > v2
donc
v1 > v3 > v2
la courbe (a) correspond à l’expérience 1
la courbe (b) correspond à l’expérience 3
la courbe (c) correspond à l’expérience 2
2.2. Influence de la forme du zinc (division et
état de surface)
2.2.1. La vitesse de réaction correspondant à l'expérience 4 est plus élevée que celle de En effet l’état final est atteint beaucoup plus rapidement. La poudre de zinc réagit plus rapidement avec l'acide que la grenaille de zinc.
En effet la poudre de zinc offre une plus grande surface de contact avec la solution.
2.2.2 Dans l'expérience l’avancement reste quasi égal à 0 : la réaction se déroule très lentement. En effet la couche de carbonate de zinc protège le métal de l'attaque acide.

.