Cinétique de réaction du diiode /
oxydoréduction
Ox + n.e- = Red
Ox1/Red1 et Ox2/Red2.
a.Ox1 + b.Red2 = c.Red1 + d.Ox2
b) Pour voir la vidéo clique
ici.
Cr2O72- = 2 Cr3+
* Conservation du nombre d'atomes de l'élément oxygène par apport de
molécules d'eau :
Cr2O72- = 2 Cr3+ + 7 H2O
* Conservation du nombre d'atomes d'hydrogène par apport d'ions H+
(car la réaction a lieu en milieu acide)
Cr2O 72- + 14 H+ = 2 Cr3++
7 H2O
* Conservation des charges électriques par apport d'électrons :
Cr2O7 2- + 14 H+ + 6 e -
= 2 Cr3++ 7 H2 O
(x 6) et inversement. On fait la somme des 2 demi-équations pour obtenir
l'équation bilan.
6 x (C2H6O + H2O
= C2H 4O2 + 4 H+ + 4 e-)
=
4 Cr2O72- + 56 H+
+ 24 e- + 6 C2H6O + 6 H2O = 6 C2H4O2
+ 24 H+ + 24 e- + 8 Cr3+ + 28 H2O
On simplifie l'équation bilan :
2 Cr2O7
2-+ 16 H+ + 3 C 2H6O = 3 C2H4O2
+ 11 H 2O + 4 Cr3+
c) Réponse partielle pour voir la vidéo clique ici.
Q2
b) Première équation :
1/2 équation d'oxydation : ( 2 I-
= I2 + 2 e- ) x 1
Equation bilan : 2 Fe3+
+ 2 I- = 2 Fe2+ + I2
Seconde équation :
1/2 équation d'oxydation : ( S2O82-
+ 2 e- = 2 SO 42- ) x 1
Les 2 réactions rapides sont identiques à la réaction lente en terme
d'équation bilan !
Q3
a) Réponse
partielle, pour voir la vidéo clique ici.
xmax =
10-3 mol , le réactif en excès est le peroxodisulfate, celui en
défaut est l'ion iodure.
![]()
![]()
Concentrations
initiales des ions iodure et peroxodisulfate, notées respectivement C10
et C20 :
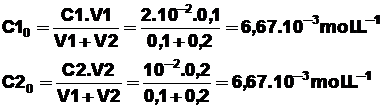
b)
Il suffit de reprendre le tableau d'avancement et de diviser les nombres de
moles par le volume
V
=V1+V2 de solution !
Tableau
d'avancement en concentrations (mol.L-1)
|
Etat du système |
Avancement |
S2O82- |
2 I- |
2 SO42- |
I2 |
|
État initial |
x = 0 |
C20 |
C10 |
0 |
0 |
|
En cours |
x(t) |
C20- x(t)/V |
|
2.x(t)/V |
x(t)/V |
c)
Concentrations molaires finales de toutes les espèces chimiques.
Pour
voir la vidéo clique ici.
|
Etat du système |
Avancement |
S2O82- |
2 I- |
2 SO42- |
I2 |
|
Etat final |
x = x(max) |
3,33.10-3mol.L-1 |
0 |
6,67.10-3 mol.L-1 |
3,33.10-3mol.L-1 |
Q5
![]()
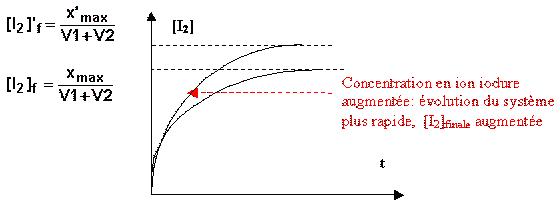
2 différences importantes :
® Plus la concentration des réactifs est importante, plus
la vitesse de réaction est importante, et plus vite on atteint la valeur de
l'avancement maximal.
® La concentration en ion
iodure étant plus importante, l'avancement maximal est plus important, donc la
concentration en diiode finale augmente par rapport à la première expérience.
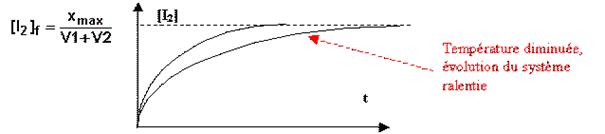
b) On garde le mélange initial mais on
diminue sa température (la réaction est considérée comme athermique).
Plus la température est
faible, plus le système évolue lentement, plus la durée au bout de laquelle xmax
est atteint est importante.