Suivi conductimétrique d'une transformation
chimique (énoncé)
Q1
L'alcool est l'éthanol C2H5OH.
b) La conductance est une fonction croissante de la concentration en
ions, ainsi que de leur conductivité molaire ionique.
La réaction chimique étudiée est :
C4H8O2(aq) + HO
- = CH3CO2- + C2H5OH(aq)
La concentration en ion hydroxyde diminue, alors que celle en ion
éthanoate augmente. La conductivité molaire ionique en ion hydroxyde étant
supérieure à celle des ions éthanoate, la conductance de la solution va
diminuer.
Q2
a) Réponse partielle pour voir la correction vidéo, cliquer ici.
![]()
b) A t = 0, le tableau donne Go = 46,2 mS.
c) Réponse partielle pour voir la correction vidéo, cliquer ici.
![]()
Q3
a) Réponse partielle pour voir la correction vidéo, cliquer ici.
![]()
b) Au bout d'un temps très long, G = Gf = 10,7 mS.
c) Pour voir la correction vidéo, cliquer ici.
Q4
a) Pour calculer les valeurs de x, il suffit de prendre les valeurs de G au
cours du temps dans le tableau. Exemple :
à t = 30 s, G = 18,6 mS (Go = 46,2
mS, Gf = 10,7 mS) .
![]()
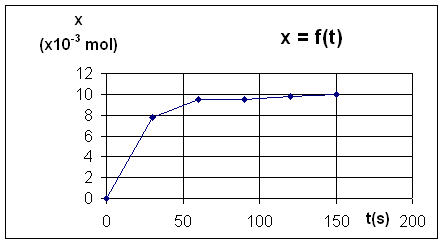
Le tableau des valeurs de l'avancement 'x' au cours du temps est :
|
t(s) |
0 |
30 |
60 |
90 |
120 |
150 |
|
x(10-3mol) |
0 |
7,77 |
9,52 |
9,55 |
9,77 |
9,97 |
Remarque :
1) Pour construire un tableau, expliquer comment trouver la première
valeur (pour satisfaire la curiosité naturelle du correcteur).
2) Laisser les conductances en mS (un rapport de même unité est sans
unité!)
b) Courbe des variations de l'avancement x au cours du temps :