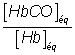Chapitre 5 : constante d’acidité d’un couple acide base
TRANSPORT DU DIOXYGÈNE DANS LE SANG (2007/03 Nouvelle Calédonie
session remplacement 2006)
1. Transport du dioxygène
dans l’organisme par l’hémoglobine du sang
1.1. quantité de matière n0
de sous-unités d’hémoglobine
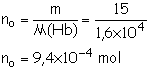
1.2.
|
équation chimique |
Hb(aq) + O2(aq)
=
HbO2(aq) |
|||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
||
|
État
initial |
x
= 0 |
n0 |
excès |
0 |
|
En
cours de transformation |
x |
n0
– x |
excès |
x |
|
État
final si totale |
xmax |
n0
– xmax |
excès |
xmax |
|
État
final |
xf |
n0
– xf |
excès |
xf |
Le
dioxygène étant en excès, le réactif limitant est Hb. si la réaction est
totale, la quantité de matière de sous unités d’hémoglobine et
totalement consommé :
n0
– xmax = 0.
xmax = n0 = 9,4´10–4 mol
1.3. Taux d’avancement
final :
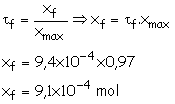
1.4
D’après le tableau d’avancement du 1.2 :
Dans
l’état final, la quantité de matière de sous-unités d’oxyhémoglobine HbO2,
est :
n(HbO2)f = xf
,= 9,1´10–4 mol.
1.5. Pour un volume V = 0,100 L de sang oxygéné, xf = 9,1x10-4 mol de HbO2
est produite
En
une minute un volume VS = 5,0 L = 50xV de sang est oxygéné,
La
quantité de matière HbO2 produite
est :
nS =50.xf =
50x9,1x10--4
nS = 4,5´10–2
mol
2. Libération du dioxygène
au niveau des organes
Etat
initial, noté état 1 est tel que la
concentration en dioxygène dissous est [O2]1 = 3,6 ´ 10 –5 mol.L–1 ; celle de sous-unités
d’hémoglobine est alors [Hb]1 = 2,8 ´ 10 –4 mol.L–1
et celle de sous-unités d’oxyhémoglobine est [HbO2]1
= 9,1 ´
10 –3 mol.L–1.
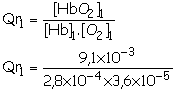
Qr1 = 9,0x105.
3. Et lors d’un effort
musculaire ?
3.1. Equation notée (2) de la
réaction associée à la transformation entre le dioxyde de carbone dissous et
l’eau.
CO2,H2O + H2O(l)
= HCO3–(aq) + H3O+ équation (2)
3.2. Domaines de prédominance
des espèces du couple CO2,H2O / HCO3– :

3.3.Si pH = 7,4 > pKa
alors d’après le diagramme de prédominance la
base HCO3– prédomine.
3.4. CO2,H2O +
H2O(l) = HCO3–(aq) + H3O+ équation (2)
La
dissolution du dioxyde de carbone produit des ions oxonium H3O+ dans
le sang
[H3O+]
augmente,
pH
= – log [H3O+]
donc le pH diminue.
3.5. HbO2(aq) + H3O+ = O2(aq) + HbH+(aq) + H2O équation
(3)
la
réaction d’équation (2), produit des ions H3O+
La
réaction 3 consomme ses ions et produit du dioxygène. 2 avantages de cette
réaction :
-éviter
la diminution du pH sanguin puisque des ions H3O+ sont
consommés
-libération
de dioxygène nécessaire à l’effort musculaire.
4. Empoisonnement au monoxyde de carbone
4.1. Hb(aq) + CO(aq) = HbCO(aq) (équation 4) avec
K4 = 7,5 ´ 107
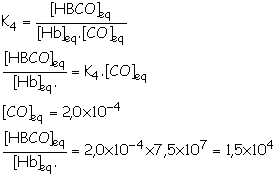
|
|
de
1,1 ´
10 4 à 2,6 ´10 4 |
de
2,6 ´
10 4 à 2,6 ´ 10 5 |
Supérieur
à 2,6 ´
10 5 |
|
Effets |
Maux
de tête |
Intoxication
grave |
Mort
rapide |
Le
rapport des concentrations est compris entre 1,1x104 et 2,6x104 :
la personne ressent des maux de tête.