RÉACTIONS
TOTALES ? (2008 Amérique du nord
)
1.
L’ammoniac
1.1.
Le taux d’avancement de la réaction est égal au
rapport de l’avancement final xf sur
l’avancement maximal : ![]()
1.2. t
< 1, la réaction n’est donc pas
totale, elle est partielle (la réaction dans le sens indirecte est
possible)
1.3.
|
Équation de la réaction |
N2(g) + 3 H2(g) = 2 NH3(g) |
|||
|
État |
Avancement |
n(N2) en
mol |
n(H2) en
mol |
n(NH3) en
mol |
|
Initial |
0 |
1,0.102 |
3,0.102 |
0 |
|
En cours |
x |
1,0.102 –
x |
3,0.102 –
3.x |
2.x |
|
Final |
xf |
1,0.102 – xf |
3,0.102 –
3.xf |
2.xf |
Calcul de xf :
xf = t.xmax.
Le mélange contient
1,0.102 mol de diazote et 3,0.102
mol de dihydrogène. Les réactifs ont été introduits dans les proportions
stœchiométriques en effet :
N2
(g) + 3 H2
(g) = 2 NH3 (g)
n(N2)initial
-xmax
= O donc : x = 1,0.102 mol.
xf = t.xmax
= 0,7x102 = 70 mol
La composition finale
du mélange est :
n(N2) = 1,0´102 – 70 = 30 mol
n(H2) = 3,0´102 – 3´70 = 90 mol
n(NH3) = 2.xf
= 2´70
= 1,4´102 mol
1.4. D’un point de vue microscopique plus la température
est élevée plus la vitesse des molécules est importante : les chocs entre les molécules sont plus
nombreux ,la vitesse de la réaction augmente.
1.5. Le catalyseur permet d’augmenter la vitesse de
réaction sans intervenir dans son équation bilan.
2. La solution aqueuse d’ammoniac
2.1. Quantité de matière d’ammoniac dissoute :
![]()
2.1. Une base selon Bronsted est une espèce chimique
capable de capter un proton H+.
2.2.2. Réaction modélisant la transformation chimique de
l’ammoniac avec l’eau.
NH3(aq) + H2O(l) = NH4+(aq) + HO–(aq)
2.2.3. n(HO-(aq))éq = [HO-(aq)]éq.VS
le porduit
ionique de l’eau vaut :
Ke
= [H3O+(aq)]éq. [HO–(aq)]éq.
[H3O+(aq)]éq = 10–pH
Ke = 10–pH. [HO–(aq)]éq.
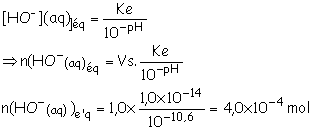
2.2.4. NH3(aq) + H2O(l) = NH4+(aq) + HO–(aq)
Si la transformation
chimique était totale :
no – xmax = 0
xmax = 1,0x10-2 mol
or xf = n(HO-)formé = 4,0x10-4 mol
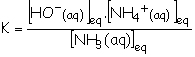
xf < xmax la réaction n’est pas totale.
2.3.1. NH3(aq) + H2O(l) = NH4+(aq) + HO–(aq).
Constante d’équilibre associée :
2.3.2.
NH4+(aq) + H2O(l)
= NH3(aq) + H3O+(aq)

3.
Étude d’un mélange d’acide éthanoïque et d’une solution aqueuse d’ammoniac
3.1.1. CH3CO2H(aq) +
NH3(aq) =
CH3CO2– (aq) + NH4+(aq) (équation 1)
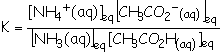
On multiplie le dénominateur et le numérateur par
[H3O+]

3.1.2. Dans l’état
initial :
[CH3CO2–
]= [NH4+] = 0
Qr, i = 0
Qr, i < Qr,éq
Le système va évoluer dans le sens direct de la
réaction.
3.2.
Composition du mélange
3.2.1. Diagramme de prédominance des espèces :

3.2.2. Le
pH du mélange est : pH = 9,2 = pKa2 par conséquent
[NH3]éq
= [NH4+]éq
3.3. CH3CO2H(aq) +
NH3(aq) = CH3CO2– (aq) + NH4+(aq)
D’après l’équation 1, il se forme la même quantité
de matière d’ions éthanoate que d’ions ammonium :
[NH4+]éq = [CH3CO2–]éq.