EXERCICE II : POURQUOI CUISINER
DANS DES CASSEROLES EN CUIVRE ?
 Amérique
du nord CORRECTION
© http://labolycee.org (7
POINTS)
Amérique
du nord CORRECTION
© http://labolycee.org (7
POINTS)
Partie A : Étamage d’une casserole
1.1.
1.2.
L’électrolyse n’est
pas une transformation spontanée.
La transformation chimique
ne peut avoir lieu que grâce
anode cathode
à l’apport
d’énergie du générateur.
2.1. La borne – du générateur apporte des
électrons qui sont consommés par une réaction de
réduction. L’électrode
A reliée à la borne – est la cathode.
L’électrode B est l’anode, il s’y produit une
oxydation qui libère des électrons
« pompés » par la borne + du
générateur.
2.2.
À l’électrode A : l’oxydant Sn2+ est
réduit, Sn2+(aq) + 2 e– = Sn(s).
Cette électrode est
effectivement constituée par le récipient qui se recouvre alors
d’étain solide.
2.3.
L’électrode B est constituée d’étain Sn(s)
pur, celui-ci est oxydé : Sn(s) = Sn2+(aq)
+ 2 e–.
2.4.
Équation de la réaction globale : Sn2+(aq)A + Sn(s)B = Sn2+(aq)B
+ Sn(s)A.
Cette
équation montre qu’il y a autant d’ions Sn2+
consommés que d’ions Sn2+ formés, ainsi la
concentration des ions étain dans la solution ne varie pas au cours de la réaction.
3.1. Q = I.Dt
3.2. D’après la demi-équation de réduction, pour
chaque mole d’étain déposée ce sont deux moles
d’électrons qui sont échangées : ![]() .
.
3.3. Q = n(e–) . F
3.4. Q =
I.Dt = n(e–)
. F = 2nSn . F = 2.![]() .F
.F
Dt = 2.![]() .F
.F
4.1. V = S.e
= 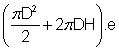 il faut convertir e en cm
il faut convertir e en cm
V = 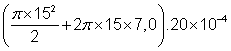 = 2,0 cm3 Valeur non arrondie stockée en
mémoire
= 2,0 cm3 Valeur non arrondie stockée en
mémoire
4.2. r = ![]() donc m = r.V
donc m = r.V
m = 7,30 ´ 2,026 = 14,79 = 15
g calcul effectué avec la valeur non
arrondie de V
4.3. Dt = 2.![]() .F
.F
Dt = 2´![]() ´9,65´104 = 9,6´104
s soit environ 27 h
´9,65´104 = 9,6´104
s soit environ 27 h
calcul effectué avec mSn
non arrondie
Partie B : Pourquoi ne pas utiliser un autre
métal ?
1.1. La demi-équation associée au premier couple est du type
Réd = Ox + ne–, c’est une oxydation. La
demi-équation associée au second couple correspond à une
réduction :
O2(g) + 4e– + 4H+(aq)
= 2H2O(l).
1.2. O2(g) + 4e–
+ 4H+(aq) = 2H2O(l) )´3
2
Fe(s) + 4H2O(l)
= (Fe2O3,H2O)(s) + 6 H+(aq)
+ 6e– )´2
![]() équation de la réaction globale :
équation de la réaction globale :
3O2(g) + 12H+(aq) +
4 Fe(s) + 8H2O(l)
= 6H2O(l) +
2(Fe2O3,H2O)(s) + 12 H+(aq)
soit 3O2(g) + 4 Fe(s) + 2H2O(l) = 2(Fe2O3,H2O)(s)
 1.3.
1.3.
L’électrode
d’étain est disposée au centre
de la boite de conserve sans
la toucher.
Cette électrode
libère des ions Sn2+ qui vont
être réduits en
étain métallique sur la face interne de
la boite de conserve,
reliée à la borne –.
2.1. Selon Bronsted, un acide est une espèce chimique capable de libérer un proton H+.
2.2. HA(aq) + H2O(l) = A–(aq) + H3O+
2.3. [H3O+]1
= 10–pH1
[H3O+]1
= 10–3,0 = 1,0´10–3 mol.L–1 pour le jus d’orange.
2.4.
L’aluminium est très réactif vis-à-vis des acides et
des bases.
Le jus d’orange,
étant très acide, peut réagir avec l’aluminium.
Le lait possède un pH
de 6,7, il s’agit d’une solution quasiment neutre qui ne
réagira pas avec l’aluminium.
L’aluminium est
théoriquement moins recommandé pour le jus d’orange que
pour le lait.