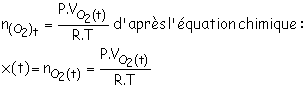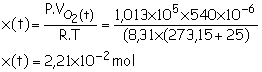De l’importanc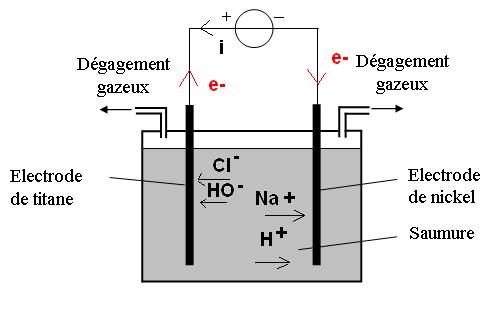 e de l’eau oxygénée (Liban 2009 ; 7
points)
e de l’eau oxygénée (Liban 2009 ; 7
points)
1. Préparation du dihydrogène par électrolyse
1.1. (vidéo) Les électrons circulent de la borne – du générateur vers la borne + (sens inverse du courant électrique). Ils arrivent dans l’électrode de nickel et attirent les cations. Les cations vont vers la cathode donc l’électrode de nickel est la cathode. A l’anode, électrode de titane, des électrons partent. Ils sont fournis par les anions : l’anode attire les anions. Dans la solution, les anions sont attirés par l’anode reliée au pôle positif du générateur et les cations vers la cathode reliée au pôle négatif.
1.2. (vidéo) À la cathode, ½ équation de réduction avec production du dihydrogène gazeux :
2H+(aq) + 2e– -> H2(g)
À l’anode, ½ réaction d’oxydation avec production du dichlore gazeux :
2Cl–(aq) -> Cl2(g) + 2e–
1.3. (vidéo) Le volume de H2 libéré est : VH2 = nH2.Vm (1)
D’après la demi-équation de réduction 2 moles d’électrons sont consommées lorsqu’une une mole de dihydrogène est formée, n(H2) = n(e-)/2.
1 mole d’électron correspond à la charge Q1 = Na.e
La charge débité dans le circuit est :
![]() ,
,
elle correspond à n(e-) = 2.n(H2)
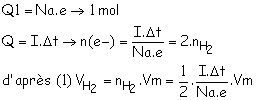
Production de H2 en 1 heure de fonctionnement :
![]()
V(H2 ) = 28,0´103 L = 28,0 m3
2. Cinétique de la dismutation de l’eau oxygénée.
|
2.1.1. |
2H2O2(aq) = O2(g) + 2 H2O(l) |
|||
|
État |
Avancement |
Quantités de matière en mol |
||
|
État initial |
0 |
c.V |
0 |
Excès |
|
En cours de transformation |
X |
c.V – 2.x |
x |
Excès |
|
État final |
xf |
c.V – 2.xf |
xf |
Excès |
2.1.2. L’avancement maximal est atteint lorsque l’eau oxygénée est entièrement consommée :
c.V – 2.xmax = 0
xmax =c.V/2
xmax = (2,5x24x10-3)/2
xmax = 3,0´10–2 mol
2.1.3. (vidéo 2.1.3 et 2.1.4) D’après la loi des gaz parfaits :
|
|
|
|
|
|
2.1.4. À la date t = 30 min, le tableau de résultats indique VO2 (30) = 540 mL= 540´10–6 m3,
|
|
|
|
|
|
.
2.2.Analyse du graphe x(t)
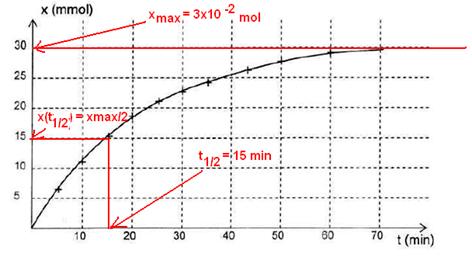 2.2.1.(vidéo
)Le temps de
demi-réaction est la durée au bout de laquelle l’avancement a atteint la moitié
de sa valeur finale. Graphiquement, t1/2 = 15 min.
2.2.1.(vidéo
)Le temps de
demi-réaction est la durée au bout de laquelle l’avancement a atteint la moitié
de sa valeur finale. Graphiquement, t1/2 = 15 min.
2.2.2. Hors programme (vidéo )La vitesse volumique v(t) de réaction est définie par :
![]()
avec V volume de solution. Au cours du temps la
pente de la tangente à la courbe x(t), dx/dt, diminue. Par conséquent la
vitesse, qui est proportionnelle à la pente, diminue également.
2.3. Facteurs cinétiques
 2.3.1. La vitesse de réaction va diminuer car la concentration de la
solution en eau oxygénée diminue au cours du temps. Interprétation
microscopique (à l’échelle des atomes et molécules) : moins il y a de
réactifs, moins il y a de chocs entre eux et plus la formation de produits
diminue.
2.3.1. La vitesse de réaction va diminuer car la concentration de la
solution en eau oxygénée diminue au cours du temps. Interprétation
microscopique (à l’échelle des atomes et molécules) : moins il y a de
réactifs, moins il y a de chocs entre eux et plus la formation de produits
diminue.
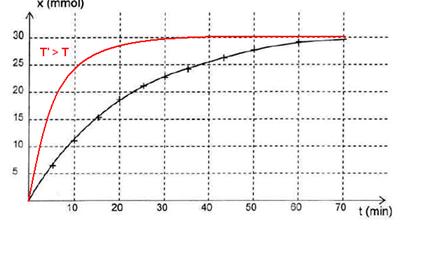
2.3.2. La température est un facteur cinétique. Plus la température augmente plus l’état final est atteint rapidement. Attention l’avancement final n’est pas modifié. Sa valeur est juste atteinte plus rapidement.
2.3.3. Proposition 1 : L’avancement final est divisé par deux. FAUX
La quantité de matière d’eau oxygénée introduite initialement n’est pas modifiée, l’état final sera inchangé (xmax =c.V/2).
Proposition 2 : L’état final est atteint plus rapidement. VRAI
On ajoute moins d’eau distillée que précédemment (seulement 0,50 L au lieu de 1,0 L), la concentration de la solution en eau oxygénée est plus grande, l’état d’équilibre sera atteint plus rapidement.
2.4.1. Un catalyseur est une espèce chimique qui permet d’atteindre plus rapidement l’état final d’équilibre d’un système chimique, sans apparaître dans l’équation de cette réaction
2.4.2. Le catalyseur et les réactifs sont dans la même phase : en solution aqueuse : il s’agit d’une catalyse homogène.