Pile et
électrolyse avec le cuivre (d’après Bac Maroc 2004)
I.
Pile et électrolyse avec le cuivre
1.1.1. Borne
positive :Cu2+ (aq)1 + 2e– = Cu(1)(s) ;
Borne négative : Cu(2) (s) = Cu2+(aq)2 +
2 e–
1.1.2. Borne
positive : réaction de réduction
(car gain d’électrons) ; Borne négative : réaction d’ oxydation
car perte d’électrons.
1.1.3.
Equation de fonctionnement de la pile :
Cu2+1 (aq) + Cu(2) (s) = Cu(1)(s) + Cu2+2(aq)
1.2.1. valeur du quotient réactionnel initial Qr,i
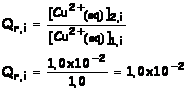
1.2.2.
Qr, i
< K : le système évolue dans le sens direct, ce qui est cohérent avec
la polarité proposée. En effet la réaction qui se déroule spontanément est
celle qui consomme l’ion cuivre du compartiment 1. Sa concentration diminue,
alors que celle du compartiment 2 augmente. Qr augmente jusqu’à la valeur K =
1.
1.3.1.

:
1.3.2 Quand
l’état d’équilibre est atteint : Qr,
éq = K
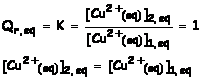
À l’équilibre, les
concentrations en ions cuivre (II) dans les deux compartiments sont identiques.
1.3.3
Quantité d’électricité débitée par la pile :
![]()
Quantité de matière
d’électrons ayant circulé dans le circuit :
![]()
1.3.4 La
réaction ayant lieu est:
Cu2+1
(aq) + Cu(2) (s) + 2.e- = Cu(1)(s) + Cu2+2(aq) +2e-
La quantité de matière d’ion
cuivre ayant disparue est :
n(Cu2+)1
= x
La quantité de matière
d’électrons ayant circulée est :
n(e-) = 2.x
n(Cu2+)1 = x = n(e-)/2 = 6,2x10-3/2
= 3,1x10-3 mol
1.3.5 La
nouvelle concentration en ion cuivre dans le compartiment 1 est:
[Cu2+]1’
= [Cu2+]1,initiale – x/V = 1,0 – 3,1x10-3
/0,1
[Cu2+]1’ = 0,969 mol.L-1
2.1.1. Pour réaliser
le dépôt, il est nécessaire d’ajouter un générateur dans le circuit extérieur.
2.1.2. La bague doit être à la
place de l’électrode du compartiment 2. En effet le générateur produit une
réaction dans le sens inverse de celle
s’effectuant spontanément avec la pile :
Compartiment 1 relié à la
borne positive du générateur :
Cu(1)(s) = Cu2+
(aq)1 + 2e– ;
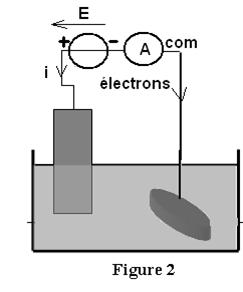 Compartiment
2 relié à la borne négative du générateur :
Compartiment
2 relié à la borne négative du générateur :
Cu2+(aq)2 + 2 e– = Cu(2)
(s)
2.1.3. Les électrons arrivent
dans le compartiment 2 pour réaliser une réaction de réduction.
Le courant i sort par la
borne + du générateur et arrive dans le comprtiment 1 ou a lieu une réaction
d’oxydation.
2.2.1.
2.2.2.
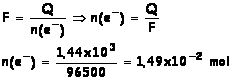 l
l
2.2.3. La réaction ayant lieu
au cours de l ‘électrolyse est :
Cu(1)(s)
+ Cu2+(aq)2 + 2 e– = Cu2+ (aq)1 + 2e– + Cu(2) (s);
ndis(Cu2+)2 = x
La quantité de matière
d’électrons ayant circulé est:
n(e-) = 2.x
La
relation entre la quantité de cuivre qui a disparu ndisp (Cu2+)
et la quantité de matière n(e–) d’électrons qui a
circulé est :
![]()
2.2.4. ndép(Cu)2 = ndis(Cu2+)
=>

2.2.5. m(Cu) = ndép(Cu)2.M(Cu)
m(Cu) = 7,5 ´ 10–3 ´ 63,5 = 4,8 ´
10–1 g