Pile
nickel zinc (Antilles Bac 2003) énoncé
Q1
a)
Pour voir la correction vidéo clique
ici.
b) Des électrons pénètrent dans l’électrode positive.
Celle-ci est le siège d’une réduction des ions nickel.
½ réaction de
réduction :
Ni2+aq + 2 e- = Ni(s)
Des électrons sont émis à partir de l’électrode négative.
Celle-ci est le siège d’une oxydation du métal zinc.
½ réaction d’oxydation :
Zn(s)
= Zn2+ + 2 e-
c) D’après les ½ réactions de réduction et d’oxydation,
l’équation d’oxydo-réduction est :
Zn(s)
+ Ni2+(aq) = Zn2+(aq)
+ Ni (s)
d) Réponse partielle, pour voir la correction vidéo clique
ici.
Qr(i) = 1
Q2
a) Réponse partielle, pour voir la correction vidéo clique ici.
Qr augmente et tend vers K.
b)
Réponse partielle, pour voir la correction vidéo clique
ici.
xmax = 5 x 10-3 mol
c)
Réponse partielle, pour voir la correction vidéo clique
ici.
Q = 965 C
Q3
a)
Réponse partielle, pour voir la correction vidéo clique ici.
n (Ni2+)
= 1,7 x 10-3 mol
b)
Réponse partielle, pour voir la correction vidéo clique
ici.
Q = 328 C
c)
Valeur de l’intensité du courant (durée t = 1h = 3600 s) :
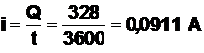
Q4
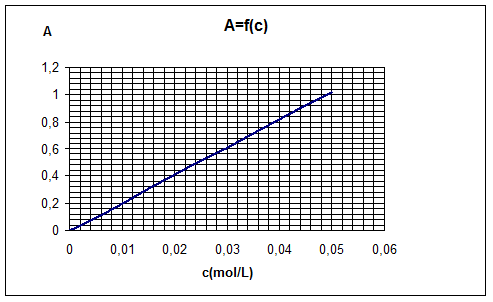
a) Courbe représentant l’absorbance en fonction de la
concentration ‘c’ d’ion Nickel Ni2+ dans la solution.
b)
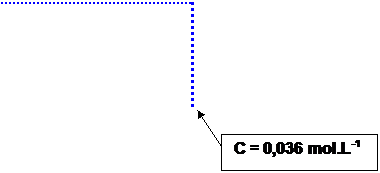
L’absorbance A = 0,67 ; d’après la courbe la concentration de la solution
en ion nickel Ni2+ est c = 0,036 mol.L-1
.
c)
La concentration restante en ion nickel est :
c
= 0,036 mol.L-1. La concentration initiale
était de 0,05 mol.L-1. La concentration en
ion nickel ayant disparue est égale à : 0,05 - 0,036 = 0,014 mol.L-1
On
a trouvé dans la question Q3 a) une concentration en ion nickel ayant disparue
de 0,017 mol.L-1. Les résultats sont
similaires.
L’erreur
relative est égale à :
![]()