Chapitre 3 : sources de lumières colorées
I) quels sont les
différents types de sources lumineuses ?
1) sources
lumineuses chaudes et froide
Les sources lumineuses chaudes produisent à la fois de la lumière et de la chaleur.
Exemple :
- les lampes à incandescence ( de mauvais rendement donc progressivement abandonnées)
- les étoiles
- le feu etc..
Les sources lumineuses froides produisent essentiellement de la lumière.
Exemple :
- le néon (gaz qui, excité par une tension électrique, produit de la lumière)
- les diodes électroluminescentes (D.E.L) utilisées comme témoin lumineux d’appareils électrique ou comme phares de voiture.
Une source lumineuse peut être :
- monochromatique si elle n’est constitué que d’une seule radiation lumineuse (laser par exemple)
- polychromatique si elle est constituée de plusieurs radiations lumineuses (lampes spectrales, soleil etc..)
2) longueur d’onde
d’une radiation lumineuse
La lumière est une onde électromagnétique. A chaque onde
lumineuse correspond une fréquence u (nu) et une période T telle que:
![]()
Unité :
![]()
La célérité d'une onde lumineuse dans le vide (ou
l'air) est :
Chaque onde lumineuse possède une
longueur d'onde ![]() (périodicité spatiale)
qui correspond à la distance parcourue par l'onde en une période T. La longueur
d’onde est le produit de la célérité par la période de vibration de l’onde :
(périodicité spatiale)
qui correspond à la distance parcourue par l'onde en une période T. La longueur
d’onde est le produit de la célérité par la période de vibration de l’onde :
![]()
Unité: ![]() (m) ; T(s);
(m) ; T(s); ![]() (Hz)
(Hz)
Dans le vide les radiations lumineuses visibles par l’œil humain sont comprises entre 400 nm et 800 nm environ.
Spectre d’émission de la lumière blanche
![]()
Exemple :
- une radiation lumineuse bleue possède une longueur d’onde dans le vide de 450 nm
- une radiation lumineuse jaune possède une longueur s’onde dans le vide de 600 nm
Remarque : seules les ondes électromagnétiques comprises entre 400 nm et 800 nm sont visibles. Les autres types d’ondes sont présentés sur le tableau suivant :

II) influence de la
température sur la lumière émise
1) loi de Wien
Animation : lumière
émise par un corps chauffé
La lumière émise par un corps chauffé ne dépend que de sa température. Elle ne dépend pas de la composition chimique du corps.
La loi de Wien
donne la relation entre la longueur
d’onde ![]() de la radiation émise avec le maximum d’intensité
par le corps chauffé et la température
de la radiation émise avec le maximum d’intensité
par le corps chauffé et la température ![]() du
corps :
du
corps :
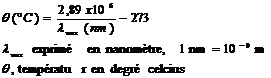
2) exploitation de
la loi de Wien
A partir de l’analyse spectrale du corps on peut déterminer
la valeur de ![]() . La loi de
Wien permet alors de connaitre la température de surface du corps.
. La loi de
Wien permet alors de connaitre la température de surface du corps.
Exemple : ![]()

Application : déterminer la température de surface des étoiles à l’aide d’une analyse spectrale.
On peut également, connaissant la température du corps, déterminer la valeur de la radiation lumineuse de plus forte intensité qu’il émet :
Exemple : un corps est chauffé à une température ![]() .La radiation d’intensité lumineuse maximale qu’il émet
est :
.La radiation d’intensité lumineuse maximale qu’il émet
est :
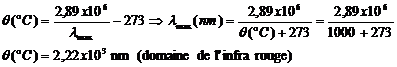
III) pourquoi un
gaz excité par une tension électrique émet-il de la lumière ?
Animation :
spectres d’émission discontinus
On a vu en seconde qu’un gaz sous basse pression, excité par une tension électrique, produisait un spectre d’émission discontinu. Exemple le spectre d’émission d'une lampe à vapeur de mercure :

Pourquoi ?
1) le photon
La lumière est constituée de corpuscules appelés
photons. A chaque photon correspond une onde électromagnétique de
longueur d'onde ' ![]() ', de fréquence '
', de fréquence '![]() ' et de
célérité 'c' dans le vide (c = 3,00x108 m.s-1 ). Un
photon a une masse nulle et une énergie E, produit de la constante de Planck
'h' par sa fréquence '
' et de
célérité 'c' dans le vide (c = 3,00x108 m.s-1 ). Un
photon a une masse nulle et une énergie E, produit de la constante de Planck
'h' par sa fréquence ' ![]() '. Dans le cas ou le photon se déplace
dans le vide son énergie est :
'. Dans le cas ou le photon se déplace
dans le vide son énergie est :
![]()
unité : E en joule, h = 6,62.10-34
J.s, T période de l'onde électromagnétique(s); '![]() ' fréquence
(Hz) ; 'c' célérité (m.s-1).
' fréquence
(Hz) ; 'c' célérité (m.s-1).
L’énergie d’un photon étant très faible on utilise souvent l’électronvolt(eV) comme unité d’énergie.
1 eV = 1,60x10-19 J.
2) Quantification
des niveaux d'énergie électronique d'un atome : postulat de Bohr
Animation : émission de photon lors d’un changement de niveaux d’énergie
Afin d'interpréter le spectre d'émission de l'atome
d'hydrogène, en 1913 M. Bohr énonce les postulats suivants :
- L'atome
possède différents niveaux d'énergie bien définis, E1, E2, E3 etc. Il
s'agit de valeurs discontinues (ou discrètes), 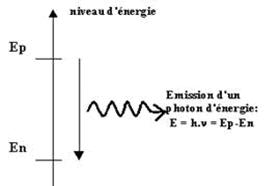 et non de valeurs continues.
et non de valeurs continues.
- Les variations d'énergie EP – En de l'atome sont quantifiées.
Lorsque l'atome passe d'un état d'énergie 'Ep' élevé à un niveau d'énergie 'En' plus faible, il libère une énergie égale à Ep - En.
Le niveau de plus basse énergie de l'atome est appelée le niveau fondamental. Lorsqu'un atome se trouve à un niveau d'énergie supérieur au niveau fondamental, on dit qu'il est excité.
Dans l’état d’énergie nulle l’atome est ionisé.
3) Emission d'un
photon/désexcitation
Animation : émission de photon lors d’un changement de niveaux d’énergie
Lorsqu'un atome se
désexcite en effectuant une transition électronique d'un niveau d'énergie Ep à
un niveau d'énergie plus faible 'En', il émet un photon d'énergie :
![]()
Unité : Ep et En en joule
(J), h constante de Planck, h = 6,62.10-34J.s , ![]() fréquence(Hz) de l'onde électromagnétique associé au
photon, c (m.s-1 ) célérité du photon.
fréquence(Hz) de l'onde électromagnétique associé au
photon, c (m.s-1 ) célérité du photon.
4) Interprétation
énergétique des spectres atomiques
Un gaz excité sous basse pression émet, en se désexcitant,
des rayonnements visibles (ou des rayonnements ultraviolets) possédant chacun
une longueur d'onde ![]() . La valeur de
. La valeur de ![]() est déterminée
par le passage d'un niveau d'énergie Ep supérieur à un niveau de
plus basse énergie En :
est déterminée
par le passage d'un niveau d'énergie Ep supérieur à un niveau de
plus basse énergie En :
![]()
L'ensemble des rayonnements lumineux de longueur d'onde ![]() va
produire le spectre de raies d'émission du gaz.
va
produire le spectre de raies d'émission du gaz.
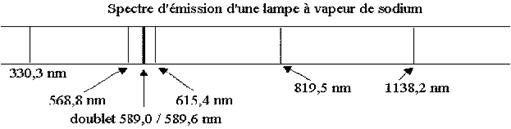
Exemple : lampe spectrale au sodium
Animation : obtention du spectre d’émission de l’atome de
sodium
Les différents niveaux d’énergie correspondant à l’atome de sodium sont représentés ci contre:

Lorsque l’atome passe d’un état excité correspondant à une énergie E1 au niveau d’énergie fondamentale E0 il émet un photon d’énergie :
![]()
La longueur d’onde du photon vaut :
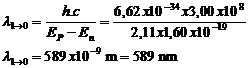
l
= 589 nm :
La radiation émise est de couleur jaune.
Les autres raies lumineuses (ou non lumineuses) sont dues à d’autres désexcitation énergétiques.
 IV) étude du spectre du soleil
IV) étude du spectre du soleil
L’étude du spectre du soleil fournit 2 informations :
- sa température de surface
- la composition chimique de son atmosphère
1) température de
surface du soleil
La raie d’intensité maximale du soleil correspond à la longueur d’onde :
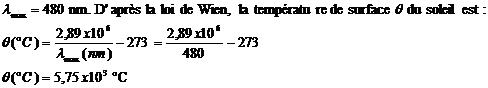
2) le spectre
d’absorption
Animation :
comparaison entre des spectres d’absorption et d’émission de quelques éléments
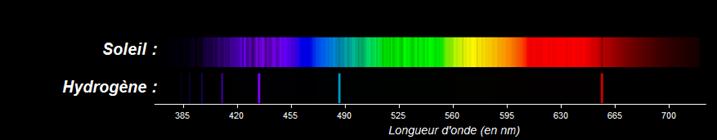
Le spectre provenant de la décomposition de la lumière du soleil est constitué de raies noires se détachant sur un fond coloré : il s’agit d’un spectre d’absorption de raies. Le soleil possède une atmosphère constituée d’un gaz sous basse pression. Ce gaz est constitué de plusieurs éléments chimiques. Ces éléments chimiques absorbent les radiations émises à l’intérieur du soleil. Les radiations que ces éléments chimiques absorbent correspondent aux radiations qu’ils peuvent émettre (radiations présentes dans leur spectre d’émission).
 Exemple :
Exemple :
Le spectre d’absorption du soleil contient certaines raies noires d’absorption correspondant aux raies d’émission de l’hydrogène. Par conséquent l’hydrogène est présent dans l’atmosphère de l’étoile.
3) interprétation
énergétique du spectre d’absorption
Lorsqu’un atome se désexcite en passant d’un niveau d’énergie Ep à un niveau d’énergie plus basse En, il émet un photon d’énergie E (photon) = Ep-En.
De la même manière lorsqu’un photon d’énergie E (photon) frappe un atome il peut être absorbé. L’atome passe alors d’un niveau d’énergie En à un niveau d’énergie supérieur Ep.
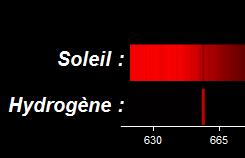 Exemple : lorsque l’atome
d’hydrogène se désexcite il émet un photon lumineux d’énergie
Exemple : lorsque l’atome
d’hydrogène se désexcite il émet un photon lumineux d’énergie
E(photon) = Ep-En. La radiation lumineuse est de couleur rouge de longueur d’onde :
![]()
Lorsqu’un photon lumineux d’énergie Ep-En va traverser l’atmosphère du soleil, il va être absorbé par un atome d’hydrogène. Le spectre du soleil va contenir une raie noire correspondant à la longueur d’onde de 652 nm. Cette raie noire nous indique que l’atmosphère du soleil contient de l’hydrogène.