I.
LES SOLIDES
IONIQUES :
1.1.
Le
cristal ionique :
Un solide
ionique est une espèce chimique constituée de cations
et d’anions
régulièrement disposés dans l’espace et formant une structure solide appelée
cristal.
La cohésion du cristal (solidité) est assurée par les interactions
électriques entre tous les ions . L’empilement des ions est tel que les
attractions électriques entre anions et cations soient maximales et les
répulsions entre ions de même charge minimales.
Les ions d’un solide ionique étant fixes, il est un isolant
électrique.
1.2.
Formule d’un solide ionique :
vidéo
Le cristal
ionique est électriquement neutre c’est-à-dire qu’il contient autant de charges
positives que de charges négatives. On
attribue au solide ionique une formule dite statistique qui traduit cette
neutralité électrique.
Exemple :
* Le cristal de chlorure de sodium (sel) est constitué d’ions
sodium Na+ et d’ions chlorure Cl-.
L’électroneutralité implique un ion Na+
pour un ion Cl- d’où la formule statistique : NaCl
* Le cristal de fluorure de calcium est constitué d’ions calcium
Ca2+ et d’ions fluorure F-.
L’électroneutralité implique un ion Ca2+
pour deux ions F- d’où la formule statistique : CaF2
II.
LE CARACTERE DIPOLAIRE DE CERTAINES
MOLECULES :
2.1.
La liaison covalente polarisée : vidéo
Les solides moléculaires (glucose), les liquides moléculaires
(eau, éthanol) et les gaz moléculaires (CO2, HCl)
sont constitués de molécules. Dans ces molécules, les atomes sont liés par des
liaisons covalentes. Dans de nombreux cas, le doublet d’électron n’est pas
localisé entre les deux atomes mais est plus fortement attiré par un atome que
par l’autre : on dit que cet atome est plus électronégatif que l’autre.
La liaison est alors appelée liaison covalente polarisée.
L’électronégativité varie avec la place d'un élément dans la
classification périodique.
·
Sur une ligne, de gauche à droite, l’électronégativité
augmente.
·
Sur une colonne, de bas en haut, l’électronégativité
augmente.
Le fluor (F) est
l’élément le plus électronégatif et le césium (Cs) est l’élément
le moins électronégatif.
2.2.
Le caractère dipolaire de
certaines molécules :
Un dipôle
électrique est un ensemble de deux charges électriques q, égales et de signes
contraires, placées à une distance fixe l’un de l’autre.
·
La molécule de chlorure d’hydrogène :
![]()
Il
apparaît donc deux pôles électriques différents et distincts aux extrémités de
la liaison H – Cl.
On dit que cette liaison est polarisée. Il en résulte que la
molécule HCl présente un caractère dipolaire.
·
La molécule d’eau : expérience : filet d’eau
devant bâton d’ébonite électrisé.
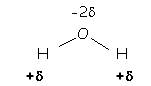
Les
deux charges ![]() sont équivalentes à
une charge fictive
sont équivalentes à
une charge fictive ![]() située au barycentre des charges positives. L’eau constituée de molécules polaires est un
solvant polaire.
située au barycentre des charges positives. L’eau constituée de molécules polaires est un
solvant polaire.
·
La molécule de dioxyde de carbone :
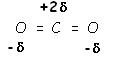
Ici, les
deux liaisons sont polarisées mais les deux barycentres sont confondus, la
molécule est apolaire.
2.3.
Molécule dipolaire : vidéo
Une molécule
est dipolaire :
·
si elle présente une liaison polarisée.
·
et si le barycentre de ses charges négatives n’est pas
confondu avec celui de ses charges positives.
III.
OBTENTION DE SOLUTIONS ELECTROLYTIQUES :
3.1.
Définition :
Une
solution électrolytique contient des ions dispersés, elle conduit le courant
électrique.
Ce type de
solution s’obtient par dissolution dans l’eau d’un électrolyte (soluté
moléculaire à caractère dipolaire ou solide ionique)
Vidéo :
dissolution et solvatation de composés ioniques
3.2.
Première étape : la dissociation :
·
Cas d’un
soluté ionique :
Le caractère dipolaire des molécules d’eau crée, entre autre,
des interactions électriques entre celles-ci et les ions du solide ionique. Ces
interactions affaiblissent celles assurant la cohésion du cristal, qui se rompt et les
ions se dispersent en solution.
Remarque : il existe des solides ioniques insolubles dans l’eau (MgO (s) ; AgCl (s)
…) dans lesquelles l’attraction entre cations et anions est trop forte pour que
les ions puissent se séparer dans l’eau.
·
Cas d’un
soluté moléculaire : expérience du jet d’eau
Le chlorure d’hydrogène gazeux est très soluble dans l‘eau.
Il se dissout d’abord dans la première goutte ce qui crée une baisse de
pression dans le ballon. L’eau du cristallisoir est alors aspirée et elle
jaillit dans le ballon. Au cours de la dissolution, les molécules d’eau
dipolaires interagissent avec les molécules également dipolaires de chlorure
d’hydrogène, ce qui affaiblit la liaison covalente entre H et Cl jusqu’à sa
rupture. Le doublet est emporté par le Cl plus électronégatif que l’hydrogène.
Les ions H+ et Cl- sont formés.
3.3.
Deuxième étape : la solvatation des ions
Comment expliquer que les anions et les cations ne se
réassocient pas en solution par interactions coulombiennes ?
Par suite d’une interaction électrique ion-solvant, des molécules
de solvants polaires entourent les ions en solution : c’est le phénomène
de solvatation des ions. Le nombre de molécules d’eau entourant un ion en
solution aqueuse dépend de la charge et de la taille de l’ion : ce nombre
est d’autant plus grand que l’ion est petit et que sa charge est élevée.
Si l’eau est le solvant on parle d’hydratation. On fait
suivre la formule chimique de l’ion hydraté de la notation (aq)
.
3.4.
Equation chimique de la mise en
solution :
Les
équations de dissolution s’écriront :
NaCl (s) ![]() Na+(aq) + Cl-(aq) ;
Na+(aq) + Cl-(aq) ;
H2SO4 (l) ![]() 2H+(aq) + SO42-(aq) ;
2H+(aq) + SO42-(aq) ;
HCl (g) ![]() H+(aq) + Cl-(aq)
H+(aq) + Cl-(aq)
L’ion H+ solvaté s’écrit
H+(aq) ou
H3O+ (ion oxonium).
L’acide chlorhydrique
peut être noté : H+(aq) + Cl-(aq)
ou H3O+ + Cl-(aq)
IV.
CONCENTRATIONS MOLAIRES :
4.1.
Concentration molaire en soluté
apporté :
(vidéo)
C’est la quantité de matière de soluté dissoute par litre de solution : C = n/Vsol
Avec C en mol.L-1 ; n en mol
et V en litre (L)
Exemple : si l’on introduit n = 1,50.10-1 mol de
NaCl(s) dans l’eau pour obtenir un volume V = 500 mL
de solution ionique, la concentration molaire de soluté apporté est :
C = 1,50.10-1/500.10-3
= 3,00.10-1 mol.L-1
4.2.
Concentration molaire des ions
présents en solution :vidéo
La concentration molaire d’une espèce X
présente en solution est égale au rapport de la quantité de matière n(X) de
cette espèce dans la solution par le volume V de la solution. On la note [X]
[X] = n(X)/V
Exemple : si l’on introduit n = 1,20 mol d’acide sulfurique
liquide pur dans l’eau pour obtenir un volume V = 250 mL de solution,
l’équation de dissolution s’écrit :
H2SO4(l) ![]() 2H+(aq)
+ SO42- (aq)
2H+(aq)
+ SO42- (aq)
La concentration d’acide sulfurique pur apporté est : C = n/V
soit C = 1,20/0,250 = 4,8 mol.L-1
[H+(aq)] =