chapitre 9 : LE SQUELETTE CARBONE DES COMPOSES ORGANIQUES
I. DIVERSITE DES CHAINES CARBONEES :
1.1. Constitution d’une molécule organique :
a- Observations : voir transparent
b- Interprétation :
- Ces molécules sont différentes mais ont un point commun : elles sont formées d’un squelette carboné ou chaîne carbonée (boules noires) auquel sont liés des atomes d’hydrogène (boule blanche).
- Dans certaines molécules, d’autres atomes comme l’azote ou l’oxygène sont présents. La molécule (e) présente une double liaison C = C : ce sont les groupes fonctionnels.
c- Conclusion :
Les molécules organiques sont constituées d’une chaîne carbonée portant des groupes fonctionnels donnant à celles-ci des propriétés particulières.
1.2. Les différentes formes du squelette carboné :
a- Chaîne carbonée linéaire :vidéo
Exemple : a – b – e – Les atomes de carbone sont les uns à la suite des autres.
b- Chaîne carbonée ramifiée : vidéo
Exemple : c – Un atome de carbone est lié à une chaîne carbonée.
c- Chaîne carbonée cyclique :vidéo
Exemple : d – la chaîne carbonée se referme sur elle-même
d- Chaîne saturée et insaturée :vidéo
Une molécule est dite saturée si les atomes de carbone sont liés par des liaisons simples. Ex: a–b–c
Une molécule est dite insaturée s’il existe au moins une double ou une triple liaison. Ex : e
II. REPRESENTATION SYMBOLIQUE D’UNE MOLECULE :
2.1. Formule brute :
Elle indique la nature et le nombre des atomes constituant la molécule. Ex C3H8
2.2. Formule développée :
Elle indique tous les atomes et toutes les liaisons. Exemple, le propane
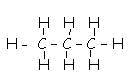
2.3. Formule semi-développée :
Elle ne mentionne pas les liaisons entre les hydrogènes et les autres atomes.
Ex: CH3 – CH2 – CH3
2.4. Ecriture topologique :vidéo
La chaîne carbonée est disposée en zigzag et est représentée par des lignes brisées.
Par convention, un atome de carbone est placé au sommet de chaque segment.
Tout autre atome que C et H est représenté par son symbole. Les atomes d’hydrogène liés à cet atome sont aussi représentés.
III. ISOMERIE :
3.1. Isomérie de constitution :
On appelle isomères de constitution, des molécules ayant la même formule brute mais des représentations développées ou semi développées différentes. On en distingue 3 types.
a- Isomérie de chaîne :vidéo
Exemple : C4H10
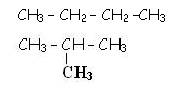
Exemple : C4H9OH
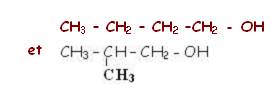
b-
Isomérie
de position vidéo:
La position du groupe
fonctionnel diffère.
Exemple : C4H8
CH2
= CH – CH2 – CH3
et
CH3 – CH = CH – CH3
Exemple : C4H9OH
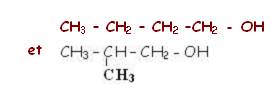
c- Isomérie de
fonction : vidéo
Les groupes fonctionnels sont différents
Exemple : C4H9OH
CH3 – CH2 – CH2 –CH2
- OH
et
CH3 – CH2 – O - CH2 – CH3
(éthoxyéhane)
3.2. Isomérie de configuration Z/E :vidéo
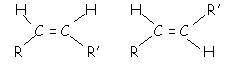
Les molécules de
type R – CH = CH – R’ présentent une isomérie de configuration Z-E
- R et R’ du même côté de la double liaison : isomère Z (zuzammer : ensemble)
- R et R’ de part et d’autre de la double liaison : isomère E (entgegen : opposé)