Chapitre 8 :
L’ETAT GAZEUX
I.
DESCRIPTION
D’UN GAZ
1. A l’échelle microscopique
Un gaz est constitué d’un ensemble de molécules,
assez éloignées les unes des autres, en
agitation permanente et désordonnée.
2. A l’échelle macroscopique
Il est donc impossible et trop compliqué, de décrire
un gaz à l’échelle microscopique, car les molécules sont en nombre trop
important et il faudrait connaître un trop grand nombre de paramètres (vitesse,
position, masse etc…).
On utilise alors, pour décrire l’état d’un gaz, des grandeurs macroscopiques, facilement accessibles à la mesure : la pression P, la température T, le volume V et la quantité de matière de gaz n.
Ces grandeurs qui permettent de décrire l’état d’un gaz sont appelées : variables d’état.
II.
NOTION
DE PRESSION :
1. Mise en évidence des forces pressantes :
On place un ballon de
baudruche contenant très peu d’air sous une cloche à vide (1). On fait ensuite
le vide d’air sous la cloche. On observe alors que le ballon se
gonfle. Son enveloppe se
tend et son volume augmente.
Dans la partie (1), la
face externe du ballon est soumise à un bombardement incessant par les
molécules des gaz constituant l’air (O2 et N2
essentiellement)
Dans la partie (2),
seule la face interne du ballon est soumise au bombardement par les molécules
enfermées dans le ballon (il n’y a plus d’air à l’extérieur). Sous l’action de
ce bombardement qui a lieu de l’intérieur vers l’extérieur, le ballon se
déforme.
Une surface en contact avec un gaz est soumise à un très
grand nombre de chocs des molécules de gaz (aspect microscopique). Il en
résulte, sur cette surface, une force appelée force pressante (aspect
macroscopique).
2. Définition :
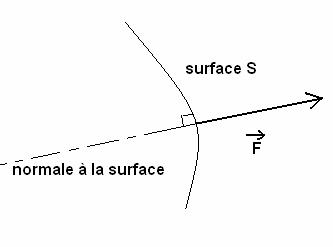
Soit F la valeur de la force pressante s’exerçant sur une surface plane d’aire S. La pression résultant de cette force est égale au rapport de la force F sur la surface S.
![]()
unités : P en
pascal (Pa) ; F en Newton (N) ; S en mètre carré (m²).
La force pressante est orthogonale à la surface sur laquelle elle s’exerce.
 Autres unités : 1 bar = 105 Pa
(industrie) ; 1 hPa = 100 Pa
(météorologie) ; 1 atm = 1,013.105
Pa ;
Autres unités : 1 bar = 105 Pa
(industrie) ; 1 hPa = 100 Pa
(météorologie) ; 1 atm = 1,013.105
Pa ;
Millimètre de mercure
(mm Hg) :
La pression
atmosphérique est la pression exercée par l’air qui nous entoure.
Au niveau du sol Pat
= 1 bar et elle diminue avec l’altitude.
3. Mesure de la pression d’un gaz :
Elle se mesure avec un
manomètre. Les baromètres mesurent la pression atmosphérique.
- Les manomètres absolus donnent la valeur de la
pression du gaz par rapport au vide.
- Les manomètres relatifs donnent la pression du
gaz par rapport à la pression atmosphérique.
III.
TEMPERATURE
ET AGITATION THERMIQUE :
La température d’un corps, à l’état solide, liquide ou gazeux, est liée à l’agitation des molécules qui le constituent. Plus les molécules sont agitées et plus la température est élevée.
Nos sens ne nous permettent
pas de caractériser objectivement la température d’un corps.
La température se mesure
avec un thermomètre. Il comporte un capteur mettant en jeu un phénomène
physique variant avec la température.
Les phénomènes les plus
courants sont :
- La dilatation : (exp du
ballon) thermomètre usuel à alcool ou à mercure,
- La résistance électrique d’un conducteur : thermomètre
électronique,
- L’émission de rayonnement : thermomètre à rayonnement infrarouge.
Pour repérer la
température d’un corps la sonde du thermomètre doit être en contact avec le
corps suffisamment longtemps : la sonde et le
corps doivent être en équilibre thermique.
- L’échelle légale de température est l’échelle
de température absolue dont l’unité est le Kelvin (K).
- Une échelle très utilisée est l’échelle Celsius
dont l’unité est le degré Celsius (°C)
La température absolue, notée T et la température Celsius notée
θ sont liées par la relation : T(K) = θ(°C) + 273,15
En l’absence de toute
agitation thermique, la température absolue T est égale à 0K : c’est le
zéro absolu. Il n’existe pas de température inférieure à 0K.