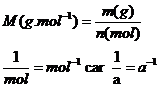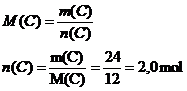|
|
Chapitre
9 : quantité de matière, son unité la mole
|
|||
|
le cours écrit 1)
De l’échelle microscopique à l’échelle macroscopique : 2)
Définition de la mole
Vidéo 3)
La constante ou nombre d’Avogadro NA Vidéo 1)
Masse molaire atomique M Vidéo 3)
Masse molaire moléculaire M Vidéo le cours vidéoI) quantité de matière qu’est
ce que la mole (au tableau) II) la masse molaire M masse molaire du chlore (cas de plusieurs isotopes)
masse et quantité de matière n = m/M masse
molaire moléculaire au tableau |
I)
quantité de matière :
1) De l’échelle microscopique à l’échelle macroscopique
:
Pour pratiquer la chimie, les chimistes doivent dénombrer le nombre d’atomes, d’ions ou de molécules appelés « entités chimiques » (échelle microscopique) présentes dans les échantillons de matière qu’ils manipulent à l’échelle humaine (échelle macroscopique). Exemple : Le nombre d’atomes de fer contenu dans un échantillon de masse m = 3,5 g sachant que la masse d’un atome fer est égale à 9,3.10-23 g se calcul ainsi : N = 3,5 / 9.3.10-23 = 3,8.1022 atomes. Ces nombres sont si grands que les chimistes ont eu l’idée, pour faciliter le décompte, de regrouper les entités chimiques en « paquets » comme dans la vie courante (Ex : feuilles de papier regroupées en rames de 500 feuilles, œufs regroupés par 6 ou 12…) comportant toujours le même nombre d’entités.
2)
Définition de
la mole Vidéo
Une mole d’entités élémentaires chimiques (atomes, ions, molécules …) est la quantité de matière d’un système contenant 6,02.1023 entités. Elle est notée avec la lettre ‘n’. La mole est l’unité de quantité de matière, son symbole est mol. Exemple : - dans 1 mole d’atomes de fer, il y a 1x6,02.1023 atomes de fer. (6,02.1023 atomes ) : n(Fe) = 1 mol - dans 2 moles d’ions cuivre Cu2+, il y a 2x6,02.1023 ions cuivre(12,04.1023 ions): n(Cu2+) = 2 mol Pourquoi ce nombre 6,02x1023 ? Calculer la masse 'm' d’une mole de nucléons (masse d’un nucléon m = 1,67x10-27 kg). m = 6,02x1023x1,67x10-27 = 1,00x10-3 kg = 1,00 g Réponse vidéo. 3)
La constante ou nombre d’Avogadro NA Vidéo
Dans 2 moles d’ions cuivre Cu2+, il y a 2x6,02.1023 ions cuivre(12,04.1023 ions) Dans 5 moles de molécule de dioxygène O2 , il y a 5x6,02.1023 molécules O2 (3,01.1024 molécules)
Le nombre d’entités N constituant un échantillon est
égale au produit de la quantité de matière par le nombre d’Avogadro NA N = n.NA Avec NA = 6,02.1023 mol-1 appelée constante d’Avogadro Exemple: n(O2) = 0,5 mol, le nombre de molécules de dioxygène correspondant à cette quantité de matière est : N(O2) = n(O2).NA N(O2) = 0,5x6,02.1023 = 3x1023 molécules II)
la masse molaire M
1) Masse molaire atomique M Vidéo
La masse molaire atomique d’un élément correspond à la masse d’une mole d’atomes de cet élément. On la note M et elle s’exprime en g.mol-1. La masse molaire atomique d’un élément est égale au
rapport de la masse ‘m (g) ’ de cet élément sur la quantité de matière
n(mol) que cela représente :
Exemple : - la masse molaire atomique de l'hydrogène est de 1,0 g/mol. Elle sera notée M(H) = 1,0 g/mol - la masse molaire atomique du carbone est 12 g.mol-1. Elle sera notée : M(C) = 12 g.mol-1 On fait réagir au cours d'une combustion m = 24 g de carbone. Quelle quantité de matière n(C) cela représente-il?
exemple vidéo : calcul de n à partir de m et M(C8H8O6) Remarque: lorsqu’un élément possède des isotopes, la masse molaire atomique tient compte des proportions naturelles de ces isotopes. exemple ; vidéo: dans la nature il y a 75,8% d’isotope de chlore 35 et 24,2 % d’isotope de chlore 37. M(Cl) = 0,758x35 + 0,242x37 = 35,5 g.mol-1
2)
Masse molaire ionique M
La masse molaire ionique correspond à la masse d'une mole d'ion. unité : g.mol-1. Elle est notée M. La masse d’un électron est négligeable devant celle d’un nucléon. Par conséquent la masse d’un atome est peu différente de celle de l’ion correspondant. La masse d’une mole d’atome est donc peu différente de la masse d’une mole d’ions : la masse molaire atomique est peu différente de la masse molaire ionique. Exemple : la masse molaire ionique de l'ion chlorure est peu différente de la masse molaire atomique de l'élément chlore: M(Cl) = M(Cl- ) = 35,5 g.mol-1 ; M(Cu) = M(Cu2+) = 63,5 g.mol-1. 3)
Masse molaire moléculaire M Vidéo
La masse molaire moléculaire représente la masse d’une mole de molécules. Elle est égale à la somme des masses molaires atomiques des éléments constituant la molécule. Unité : g.mol-1. Elle est notée M. Exemples : - masse molaire moléculaire de l'eau est: M(H2O) = 2.M(H) + 1M(O) = 18 g.mol-1 - la masse molaire moléculaire de M(C12H22O11) = 12.M(C) + 22M(H) + 11M(O) = 342 g.mol-1 exemple vidéo : masse molaire moléculaire de C8H8O6 |