|
|
Chapitre
14 : les molécules
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Cours écrit 1) qu’est ce qu’une molécule ? 2) exemple de formule brute de molécule 3) nombre de liaisons par atome 4) représentation spatiale des molécules 1) Formules développées et semi-développées : 2) méthode pour déterminer la formule développée à
partir de la formule brute 3) groupe caractéristique et famille chimique Cours en
vidéo
I) la formation des molécules 1) qu’est ce qu’une molécule ?
2) exemple de formule brute
de molécule 3) nombre de liaisons par
atome 4) représentation spatiale
des molécules II) notion d’isomérie 1) Formules développées et semi-développées : 2) méthode pour déterminer
la formule développée à partir de la formule brute 3) groupe caractéristique(fonctionnel)
et famille chimique |
I) la formation des
molécules : 1)
qu’est ce qu’une molécule ? Vidéo
Une molécule est constituée d’un assemblage d’atomes. Elle est électriquement neutre. Chaque molécule est représentée par une formule brute qui traduit sa composition. Les liaisons entre les atomes de la molécule sont représentées par des tirets. Animation : modèles compacts et éclatés de centaines de molécules (minérale, organique, biochimie) Exemple: le camphre utilisé pour chauffer les muscles des sportifs: la molécule possède 10 atomes de carbone (boules noires); 16 atomes d'hydrogène (boules blanches); 1 atomes d'oxygène (boule rouge) formule brute C10H16O
2)
exemple de formule brute de molécule
Pour écrire la formule brute d’une molécule, on écrit côte à côte les symboles des atomes qui la constituent, en précisant en indice, à droite du symbole le nombre d’atomes. Si ce nombre est égal à 1 on ne l'écrit pas. Exemples : molécule d’eau H2O : 2 atomes d’hydrogène et 1 atome d’oxygène molécule de méthane CH4 : 1 atome de carbone et 4 atomes d’hydrogène
formule brute: C9H13O2N 3) nombre de liaisons par atome
Au sein de la molécule, chaque atome a besoin d’un certain nombre de liaison pour assurer sa stabilité :
Exemple : représentation de la molécule de
diazote N2. Celle ci Représentation de la molécule de dioxyde de carbone CO2. Celle ci comporte 2 doubles liaisons entre le carbone et l’oxygène :
La molécule de méthane de formule brute CH4 comporte 4 liaisons simples entre l’atome de carbone et les atomes d’hydrogène :
- 5 liaisons simples oxygène hydrogène - 5 liaisons simples carbone oxygène - 1 double liaison carbone oxygène - 7 liaisons simples carbone hydrogène - 5 liaisons simples carbone carbone 4)
représentation spatiale des molécules
Animation : modèles compacts et éclatés de centaines de molécules (minérale, organique, biochimique) Un modèle moléculaire représente une molécule dans l’espace. On en distingue 2 types : - Le modèle compact : chaque atome est représenté par une boule de couleur déterminée.
L’atome d’oxygène est de couleur rouge, les atomes d’hydrogène sont de couleur blanche - Le modèle éclaté : les atomes sont représentés par des boules de couleur déterminée, les liaisons sont représentées par des barres Exemple : modèle éclaté de la caféine |
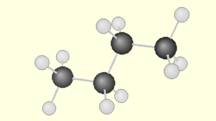 |
Le 2-méthylbutane a une structure à chaîne linéaire ramifiée
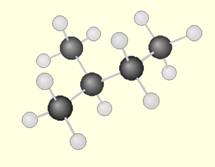
- les structures cycliques : les atomes
forment une chaîne fermée
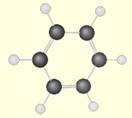 Exemple :
le benzène
Exemple :
le benzène
L'aspirine est-elle cyclique, à chaîne linéaire ou à chaîne linéaire ramifiée? L'aspirine est cyclique
II)
notion d’isomérie
1)
Formules développées et semi-développées :
L’enchaînement des atomes dans la molécule peut être
représenté par une formule développée ou semi-développée.
Dans une formule développée, toutes les liaisons entre les différents atomes apparaissent. Dans une formule semi-développée, les liaisons concernant les atomes d’hydrogène ne sont pas représentées (pour gagner du temps et de la place!).
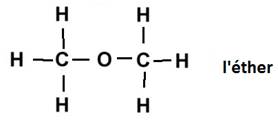
Exemples : le propane de formule brute C3H8 à pour formule développée :
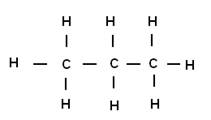
Formules semi-développée : CH3 – CH2
– CH3
L'acide butanoïque présent dans la transpiration du sportif à pour formule développée:
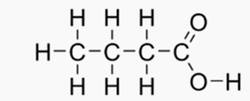
formule semi développée:
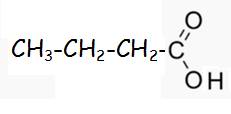
2)
méthode pour déterminer la formule développée à partir de la formule brute
A partir de la formule brute comment déterminer la formule développée d'une molécule? Prenons l'exemple de la molécule de formule brute C2H6O
1) déterminer la structure électronique de chaque atome
pour connaitre le nombre de liaison que chacun doit effectuer
- le carbone à pour numéro atomique Z = 6: structure électronique (K)2(L)4 , il va doit effectuer 4 liaisons pour respecter la règle de l'octet
- l'hydrogène à pour numéro atomique Z = 1: structure électronique (K)1, il va effectuer 1 liaison pour respecter la règle du duet
- l'oxygène à pour numéro atomique Z = 8 : structure électronique (K)2(L)6, il va effectuer 2 liaisons pour respecter la règle de l'octet.
2) dessiner tous les atomes et les relier entre eux en
respectant leur nombre de liaison
On obtient, pour cette formule brute C2H6O, 2 structures différentes donc 2 formules développées différentes
3)
groupe caractéristique et famille chimique
Un groupe caractéristique est une partie d’une molécule
qui lui confère des propriétés spécifiques. Les molécules possédant le même
groupe fonctionnel forment une famille chimique.
Les principaux groupes caractéristiques et familles chimiques sont:
|
Nom du
groupe |
Atome ou
groupe d'atomes |
nom de la
famille |
|
halogéno |
—X
F, Cl, Br, I |
composés
halogénés |
|
hydroxyle |
—OH |
alcools |
|
amino |
—NH2 |
amines |
|
carbonyle |
|
cétones |
|
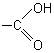
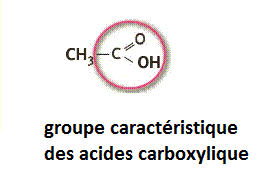
carboxyle |
|
acides carboxyliques |
Exemples : dans la molécule d’éthylamine on retrouve le groupe caractéristique amino des amines (entouré sur le dessin)

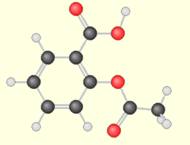
Dans la molécule d’acide éthanoïque de formule brute C2H4O2 on retrouve le groupe carboxyle caractéristique des acides carboxyliques :

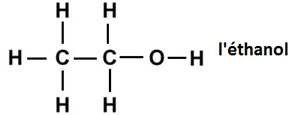
Dans la molécule d’éthanol on retrouve le groupe caractéristique hydroxyle de la famille des alcools

L'acide lactique produit au cours de l'effort possède plusieurs groupes fonctionnels (comme beaucoup d'autres molécules)

4)
Définition de l’isomérie
Deux molécules sont isomères lorsqu’elles ont la même
formule brute mais des enchaînements d’atomes différents. Par conséquent
elles ont même formule brute mais une formule développée (et semi développée)
différentes.
Elles portent des noms différents et ont des propriétés physiques et chimiques différentes.
Exemples : 2 isomères correspondent à la formule brute C4H10
a) le butane, formule semi développée : CH3 – CH2 – CH2 – CH3
b) le méthylpropane, formule semi développée
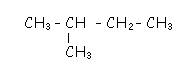
2 isomères correspondant à la formule brute C2H6O
a) l’éthanol, formule semi développée CH3 – CH2 – OH
b) Le diméthyloxyde, formule
semi développée CH3 – O – CH3
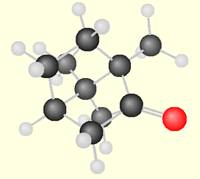
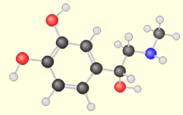 molécule
d'adrénaline
molécule
d'adrénaline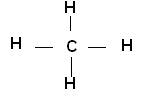
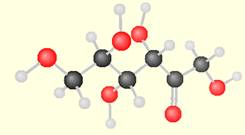 le
fructose comporte:
le
fructose comporte: Exemple :
modèle compact de l’eau de formule brute H2O
Exemple :
modèle compact de l’eau de formule brute H2O