Ds n° 5 2011/2012 corrigé
Ex 1 : Emile est
fatigué
Émile est fatigué et le
médecin a diagnostiqué une légère anémie. Le médecin prescrit donc à Émile du «
Timoférol®». Émile est curieux de connaître exactement
la formulation de ce médicament et de comprendre la prescription de ce
médicament. La notice du TIMOFEROL® et une recherche sur Internet permettent
d’obtenir les diverses informations données en feuilles annexes.
1. Étude de l’étiquette.
Quel(s) est(sont) le(s) principe(s)
actif(s) de ce médicament ? Quels sont les excipients ?
Justifier votre réponse.
2. A propos de la vitamine C
a- Quel(s) est(sont) le(s) rôle(s) de la
vitamine C dans ce médicament (répondre en utilisant les informations des annexes
2 et 3) ?
b- Quelle est la formule brute de l’acide
ascorbique ? On mettra la formule brute sous la forme CxHyOz
avec x,y et z nombres d’atomes de carbone d’hydrogène
et d’oxygène dans la molécule (il sud=ffit de compter
les atomes de chaque élément chimique composant la formule développée de
l’acide ascorbique représentée en annexe 2).
c- Calculer la masse molaire moléculaire M
de l’acide ascorbique. Ecrire son expression littérale puis effectuer
l’application numérique.
d. Donner la définition de la masse molaire
moléculaire. Donner la relation entre la masse molaire moléculaire M, la masse
m et la quantité de matière n.
e- Quelle est la quantité de matière ‘n’
d’acide ascorbique contenue dans une gélule ?
3. L’étiquette porte
l’information « Sulfate ferreux : 172,73 mg ». Formule brute FeSO4.
a- Calculer la masse molaire M1
du sulfate ferreux.
b- Calculer la quantité de matière n1
en sulfate ferreux contenue dans une gélule.
c- Calculer le pourcentage ‘P’ de fer dans
le sulfate de fer.
Annexe 1 : étiquette du
TIMOFEROL®.
Composition (par gélule) :
- Sulfate ferreux : 172,73 mg soit fer : 50
mg
- Acide ascorbique (vitamine C) : 30 mg
- Magnésium carbonate (E504) ; Talc (E553b)
; Silice (E551) ; Amidon de maïs ; Enveloppe de la gélule : Gélatine ; Titane
dioxyde (E171) ; Bleu patenté V (E131) ; Jaune de quinoléine (E104).
Dans quel cas le
médicament TIMOFEROL® est-il prescrit ?
Ce médicament contient du fer, élément
minéral essentiel au fonctionnement de l’organisme. Le fer est indispensable à
la formation de l’hémoglobine, contenue dans les globules rouges, qui assure le
transport du dioxygène dans le sang. Il est utilisé dans le traitement des
carences en fer responsables de certaines formes d’anémies.
Annexe 2 : l’acide
ascorbique ou vitamine C
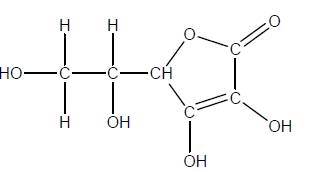 La vitamine C est une vitamine hydrosoluble
(soluble dans l'eau) C’est un puissant antioxydant qui joue un rôle essentiel
dans de nombreux processus vitaux.
La vitamine C est une vitamine hydrosoluble
(soluble dans l'eau) C’est un puissant antioxydant qui joue un rôle essentiel
dans de nombreux processus vitaux.
- Elle freine le vieillissement des
cellules.
- Elle favorise l'entretien des tissus.
- Elle accélère la cicatrisation.
- Elle augmente la résistance aux
infections.
- Elle combat l'anémie en favorisant
l'absorption du fer par l'intestin.
L’acide ascorbique possède la formule
développée ci-dessus :
Annexe 3 : à propos du
sulfate de fer II
Les ions fer II sont peu stables en
présence de dioxygène de l’air : des cristaux de sulfate de
fer II de couleur bleu-vert deviennent
lentement légèrement orangés. En effet les ions fer II
s’oxydent lentement en ions fer III de
couleur orangée.
Annexe 4 : Masses molaires
atomiques
H = 1,00 g.mol-1;
O = 16,0 g.mol-1; C = 12,0 g.mol-1; Fe = 55,8 g.mol-1;
S = 32,0 en g.mol-1
Exercice 2
On prépare une solution aqueuse sucrée par
dissolution de m = 200 g de glucose (C6H12O6)
dans un volume V = 1,00 L de solution. Masse molaire atomique : H = 1,00
g.mol-1; O = 16,0 g.mol-1; C = 12,0 g.mol-1
1) Décrire les étapes de la
préparation de cette dissolution en donnant le nom des appareils et de la
verrerie utilisée.
2) Calculer la masse molaire
moléculaire M du glucose.
3) Déterminer la
concentration massique t de la solution.
4) Déterminer la
concentration molaire C du glucose dans cette solution.
5) A 25 °C, on peut dissoudre
au maximum jusqu’à 700 g de glucose par litre de solution. Comment
qualifie-t-on alors la solution ?