Thermodynamique
Récipient à 2 compartiments (Enac QCM 2004)
|
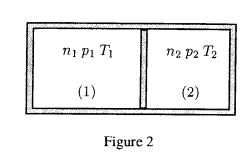
Q1 Un récipient à parois adiabatiques est séparé en deux compartiments par une paroi adiabatique. Dans
l'état d'équilibre initial, chaque
compartiment contient un gaz parfait diatomique dont on notera respectivement |
|
La paroi séparant les deux
compartiments est supprimée. Calculer
la température finale ![]() du mélange des deux
gaz à l'équilibre. On supposera que le mélange des deux gaz se comporte
également comme un gaz parfait.
du mélange des deux
gaz à l'équilibre. On supposera que le mélange des deux gaz se comporte
également comme un gaz parfait.
A)
![]() B)
B)
![]() C)
C) ![]() D)
D)![]()
Q2
Exprimer la pression
finale ![]() du mélange.
du mélange.
A) ![]() B)
B)
![]()
C) ![]() C)
C)
![]()
Q3
Exprimer les pressions finales ![]() et
et ![]() de chacun des gaz dans
le mélange en fonction de
de chacun des gaz dans
le mélange en fonction de ![]() ,
, ![]() et
et ![]() .
.
A) ![]() et
et ![]() B)
B) ![]() et
et ![]()
C) ![]() et
et ![]() D)
D)
![]() et
et ![]()
Q4
Calculer la variation
d'entropie ![]() du système constitué
par l'ensemble des deux gaz parfaits en fonction de
du système constitué
par l'ensemble des deux gaz parfaits en fonction de ![]() ,
,![]() ,
, ![]() ,
, ![]() et
et ![]() lorsque
lorsque ![]() .
.
A) 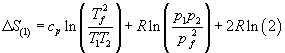 B)
B) 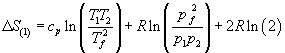
C)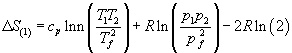 D)
D) 
Q5
Calculer la variation d'entropie ![]() du système constitué
par l'ensemble des deux gaz parfaits lorsque
du système constitué
par l'ensemble des deux gaz parfaits lorsque
![]() ,
, ![]() et
et ![]() .
.
A) ![]() B)
B) ![]() C)
C)![]() D)
D)![]()
Q6
Calculer la variation d'entropie ![]() du système constitué
par l'ensemble des deux gaz parfaits lorsque
du système constitué
par l'ensemble des deux gaz parfaits lorsque ![]() et
et ![]() et lorsque les molécules qui remplissent chaque
compartiment sont identiques.
et lorsque les molécules qui remplissent chaque
compartiment sont identiques.
A) ![]() B)
B) ![]() C)
C)![]() D)
D)![]()