Chapitre 6 : réaction acido-basique, titrage
Injections alcalinisantes (Bac Nouvelle Calédonie 2003) corrigé
Des solutions d'hydrogénocarbonate de sodium ou de lactate de sodium sont utilisées en injection par les médecins pour leurs propriétés alcalinisantes (traitement de l'excèsd'acidité).L'ion lactate est la base conjuguée de l'acide lactique(ou acide 2-hydroxypropanoïque) de formule :
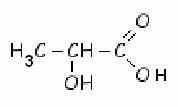
Q1
a) Recopier la formule de l'acide lactique. Entourer et nommer les groupes caractéristiques (ou fonctionnels) présents dans la molécule d'acide lactique. L'acide lactique sera noté AH dans la suite du problème.
b) Écrire la formule semi-développée de l'ion lactate. L'ion lactate sera noté A- dans la suite du problème.
Q2
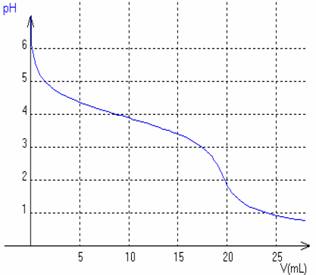
Pour vérifier la concentration d'une solution commerciale, on procède à un titrage pHmétrique des ions lactate contenus dans cette solution. On prélève un volume V1 = 20,0 mL de solution S de lactate de sodium et l'on y verse une solution d'acide chlorhydrique H3O+(aq)+Cl-(aq) de concentration molaire en soluté apporté C2 = 1,0 mol.L-1 . On mesure le pH au fur et à mesure de l'addition d'acide. On obtient la courbe donnée en fin de texte.
a) Écrire l'équation de la réaction du titrage, la transformation associée étant considérée
comme totale.
b) Déterminer graphiquement le volume d'acide versé à l'équivalence V2E, en indiquant la méthode choisie.
c) En déduire la concentration molaire en soluté apporté C1 de la solution de lactate de sodium. On pourra s'aider d'un tableau d'avancement.
d) Le pH de la solution à l’équivalence est-il basique ou acide ? Pourquoi ?
Q3
a) Pour vérifier que la réaction support du dosage est bien totale, on se place dans un cas particulier avant l'équivalence lorsque l'on a versé 9,0 mL d'acide. Calculer la quantité d'ions oxonium n(H3O+) introduite dans ces conditions.
b) Le pH de la solution est alors égal à 4,0. Calculer la quantité n’ d'ions oxonium H3O+ alors présente dans la solution.
c) En déduire que la transformation pouvait être considérée comme totale.
Q4
Dans le foie les ions lactate se décomposent en quelques heures en libérant des ions hydrogénocarbonate HCO3- .
a) Écrire l'équation de la réaction des ions hydrogénocarbonate HCO3- avec les ions oxonium H3O+ contenus dans une solution acide. (Se référer aux couples indiqués dans les données). La transformation associée sera considérée comme totale.
b) Quelle est la conséquence d'une injection de lactate ou d'hydrogénocarbonate de sodium sur le pH des liquides physiologiques contenus dans le corps en cas d'excès d'acidité ?
c) Déterminer la valeur de la constante d’équilibre K de la
question Q4 a). Conclusion.
Données :
Couples AH/A- ; H3O+/H2O ; H2O/HO-
; HCO3- / CO32- ; (CO2,
H2O)/HCO3- pKA = 6.3