Chapitre 10 : estérification hydrolyse
Préparation d'un ester (d'après baccalauréat ) corrigé
On désire préparer un ester dont la saveur et l'odeur sont celles de la banane. Cet ester est l'éthanoate de 3-méthylbutyle de formule :

il est utilisé pour aromatiser certain sirops.
Principe de la manipulation. On le prépare par l'action d'un acide (A) sur un alcool (B). La réaction se fait à chaud. On extrait par distillation fractionnée L'ester formée. Produits utilisés : un Acide A, alcool B, acide sulfurique concentré.
Données :
|
|
Solubilité dans l'eau |
Masse volumique |
|
Acide A Alcool B ester |
Bonne très faible très faible |
1,05.103 g.L-1 8,10.102 g.L-1 8,70.102 g.L_1 |
|
|
Température d'ébullition |
Masse molaire moléculaire |
|
Acide A Alcool B ester |
118°C 128°C 143°C |
88 g.mol-1 |
Masse molaire atomique : M(H) = 1g.mol-1 ; M(C)=12g.mol-1 M(O) = 16 g.mol-1;
Manipulation : première étape. Dans un ballon de 100 mL, on introduit un volume V1=44,0 mL d'alcool B est un volume V2 d'acide A. on y ajoute avec précaution 1 mL d'acide sulfurique concentré et quelques grains de pierre ponce. On adapte un réfrigérant à eau et on réalise un chauffage à reflux.
Seconde étape : après refroidissement on verse le contenu du ballon dans de l'eau, on agite et on verse dans une ampoule à décanter. Il se forme deux couches liquides n'ont miscibles dont l'une contient l'ester et l'alcool n'ayant pas réagi. On la récupère et on la soumet à une distillation fractionnée. On surveille la température et en recueille la fraction constituée de l'ester formé.
Q1
Exercice de nomenclature, pour se chauffer la noisette : donner le nom et la formule semi-développée de tous les esters de formule brute C4H8O2
Q2
a) Nommer et écrire les formules semi-développées de l'acide A et de l'alcool B utilisé. Quelle est la classe de l'alcool ?
b) Ecrire l'équation bilan de la réaction de cet acide sur l'alcool et en préciser ses caractéristiques.
c) Calculer le volume V2 d'acide nécessaire pour que le mélange avec 44,0 mL d'alcool soit équimolaire.
Q3
a) Dessiner le schéma de principe du chauffage à reflux.
b) Indiquer le rôle de la pierre ponce.
c) Pourquoi chauffe-t-on le mélange ?
d) quel est le rôle du réfrigérant .
Q4
a) Faire un schéma de l'ampoule à décanter en précisant et en justifiant dans quelle phase se trouve L'ester formé lors de la décantation.
b) Nommer les matériels repérés dans le montage à distillation fractionnée.
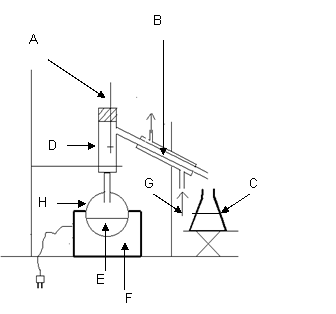
c) Pourquoi faut-il lors de la distillation surveiller la température ?
Q5
a) en récupère en réalité 26,3 g d'ester, quel est le rendement 'r' de la réaction à ce stade ?
b) Sachant que le rendement pour un alcool primaire est d'environ 67 %, la vitesse de réaction est-elle nulle à ce stade ? Comparer le quotient de réaction à la constante d'équilibre.
c) Quand la réaction est terminée donner l'expression littérale de la constante de réaction puis calculer sa valeur.
Q6
on utilise l'anhydride éthanoïque à la place de l'acide A.
a) écrire l'équation bilan de ce réactif sur l'alcool B.
b) déterminer le nombre de moles d'anhydride éthanoïque permettant de réaliser un mélange stchiométrique
c) Quelles sont les caractéristiques de cette réaction? En déduire le nombre de moles d'ester obtenu lorsque la réaction est terminée.