Chapitre 11 : contrôle de l’évolution
d’un système
La chimie au service de la parfumerie (Bac Maroc 2006 - (6,5 points)
Pour
sa création au printemps 2006, un illustre parfumeur décide d'utiliser l'odeur
de pomme et celle de la banane, effluves de son nouveau parfum. Il choisit
d'utiliser l'arôme naturel de pomme mais, pour des raisons économiques, de
synthétiser une molécule à odeur de banane.
1. UN PARFUM DE POMME
Une
des molécules présentes dans l'arôme naturel de pomme est un ester E de formule
semi-développée :

1.1.Nommer l'ester E.
1.2.
Écrire les formules semi-développées de l'acide carboxylique et de l'alcool qui
permettent la synthèse de cet ester.
1.3.
Écrire l'équation associée à la réaction d'estérification.
L'arôme
naturel de pomme est un mélange complexe constitué d'un grand nombre de
molécules, dont deux esters. Le premier est l'ester E étudié dans la question
précédente ; le second est l'éthanoate de butyle, noté B.
1.4. On donne ci-dessous les formules de plusieurs molécules : identifier et recopier celle de l'ester B.

1.5. Le parfumeur désire
extraire uniquement l'ester E de l'arôme naturel de pomme. Il procède à une
distillation fractionnée. Légender le montage qu'il utilise pour réaliser cette
extraction, donné en ANNEXE 1 (à rendre avec la copie).
2.
UN PARFUM DE
BANANE
L'ester à odeur de banane se
nomme éthanoate d'isoamyle ou éthanoate de 3-méthylbutyle, en nomenclature
officielle. Sa formule semi-développée est :
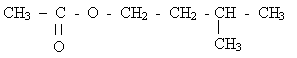
Le parfumeur décide de
synthétiser cet ester, son extraction étant trop coûteuse. Il utilise alors un mélange
d'acide éthanoïque et d'alcool isoamylique, de formules semi-développées
respectives :
CH3—COOH (acide
éthanoïque) et (CH3)2– CH – CH2 – CH2 – OH (acide isoamylique)
Avant de se lancer dans une
production à grande échelle, le parfumeur décide de réaliser l'expérience. Pour
cela, il introduit dans un erlenmeyer 1,00 mol d'acide éthanoïque et 1,00 mol
d'alcool isoamylique. Le mélange est maintenu à température constante. Il
prélève régulièrement un échantillon du mélange qu'il refroidit brutalement
puis il dose l'acide restant par une solution d'hydroxyde de sodium. La
quantité de matière d'acide est notée nA. Les résultats sont
rassemblés dans le tableau ci-dessous :
|
t (en h) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
15 |
20 |
25 |
|
nA (en mol) |
1,00 |
0,82 |
0,70 |
0,54 |
0,46 |
0,41 |
0,38 |
0,35 |
0,34 |
0,34 |
2.1.
Le tableau
descriptif de l'évolution du système est donné ci-dessous. L'avancement à une
date t est noté x.
|
Équation de la réaction |
acide
éthanoïque + alcool isoamylique =
éthanoate d'isoamyle + eau |
||||
|
État du système |
x (en mol) |
Quantités de matière (en mol) |
|||
|
État initial |
0 |
(nA)i =
1,00 mol |
(nalcool)i |
0 |
0 |
|
Date t |
x |
nA |
nalcool |
rester |
veau |
|
État final |
xf |
(nA)f |
(nalcool)f |
(nester)f |
(neau)f |
2.1.1.
Calculer la quantité de matière d'ester nester formée aux dates des
prélèvements. Compléter le tableau de mesures donné en ANNEXE 1 (à rendre avec la copie). Justifier votre réponse en
utilisant le tableau descriptif de l'évolution du système donné ci-dessus.
2.1.2.
En utilisant le tableau descriptif de l'évolution du système, déterminer la
valeur de l'avancement xf à l'état final. Justifier votre réponse.
2.1.3.
L'avancement maximal xmax de cette réaction vaut 1,00 mol. Définir
le taux d'avancement final t de la transformation. Le
calculer.
2.1.4.
Cette transformation est-elle totale ? Justifier votre réponse.
2.1.5.
Comment augmenter la valeur du taux d'avancement final pour cette réaction ?
Deux réponses sont demandées.
2.2.
La courbe représentant la quantité de matière d'ester formé en fonction du
temps est donnée en ANNEXE 1 (à rendre
avec la copie). On notera cette courbe nester = f(t).
2.2.1.
À l'aide de la courbe nester = f(t), interpréter qualitativement la
variation de la vitesse de réaction au cours du temps. Quel facteur cinétique
permet d'expliquer cette évolution ?
2.2.2.
Définir le temps de demi-réaction t1/2.
2.2.3.
En utilisant la courbe nester = f(t), déterminer graphiquement le
temps de demi-réaction de cette synthèse. Faire apparaître clairement la
construction réalisée sur le graphique.
2.2.4.
Quel est le but du refroidissement brutal effectué avant chaque dosage ?
2.2.5.
Le parfumeur décide de refaire l'expérience à une température plus élevée.
Représenter, sur le même graphique que celui représentant nester =
f(t), l'allure de la courbe obtenue dans ces conditions.
ANNEXE 1 (à rendre avec la copie)

Tableau de mesures de la question 2.1.1
|
t (en h) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
15 |
20 |
25 |
|
nA (en mol° |
1,00 |
0,82 |
0,70 |
0,54 |
0,46 |
0,41 |
0,38 |
0,35 |
0,34 |
0,34 |
|
nester (en mol) |
|
0,30 |
|
|
|
|
|
0,65 |
|
0,66 |
