Chapitre 11 : contrôle de
l'évolution d'un système
Un procédé discontinu de
fabrication du savon (Ministère) corrigé
Depuis très longtemps, la réaction de saponification des triglycérides
(triesters du glycérol) par la soude
(solution aqueuse d'hydroxyde de sodium) permet la fabrication du savon,
les triglycérides utilisés étant des
mélanges de graisses et d'huiles.
Ce procédé est encore utilisé et 90 000 tonnes de savon sont ainsi
fabriqués en France chaque année.
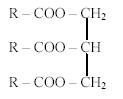
Les triglycérides ont une formule développée de la forme :
 Lascaray a obtenu l'allure de la courbe donnant la quantité de savon
fabriqué en fonction du temps.
Lascaray a obtenu l'allure de la courbe donnant la quantité de savon
fabriqué en fonction du temps.
On peut distinguer trois phases :
Phase A : démarrage de la saponification
La qualité et la finesse de l'émulsion (mélange forcé de deux liquides non
miscibles) produite lors de
l'agitation du mélange réactionnel des réactifs influe sur la vitesse de
démarrage de la réaction.
Phase B : saponification
Les ions carboxylate formés au cours de la première phase facilitent la dispersion de la graisse dans
l'eau
 grâce à la formation de micelles
grâce à la formation de micelles
Phase C : fin de la saponification
D'après « techniques de l'ingénieur, traité Génie et procédés chimiques.
On rappelle pour la compréhension de ces trois phases :
- que les graisses et les huiles
sont non miscibles (insolubles) dans l'eau ;
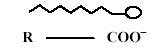
- que l'ion carboxylate peut être
schématisé de la façon suivante :
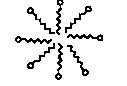
- que dans l'eau, les micelles sont
des agglomérats d'ions carboxylate.(voir figure ci-dessous)
 Q1
Q1
a) Écrire l'équation de la réaction de saponification d'un triglycéride par
la soude.
b) Indiquer quelles sont les parties hydrophile et hydrophobe de l'ion
carboxylate.
Q2
a) Décrire l'évolution de la vitesse de saponification au cours de chacune
des trois phases.
b) Expliquer pourquoi lors de la phase A, l'émulsion n'est pas de bonne
qualité. Quel est alors l'intérêt d'agiter ?
c) Phase B. Expliquer l'expression du texte : « Les ions carboxylate formés
au cours de la première phase facilitent la dispersion de la graisse dans l'eau
grâce à la formation de micelles ». Faire un schéma.
d) Quel intérêt y a-t-il à disperser la graisse dans l'eau ? Citer le
facteur cinétique qui explique que, lors de la phase C de fin de
saponification, la vitesse de la
réaction diminue. Justifier la réponse.
Q3
Un procédé discontinu de fabrication du savon : le procédé marseillais.
Ce procédé très
ancien a été
amélioré au cours
du temps, particulièrement à
Marseille d'où le
nom de procédé marseillais qui
lui est souvent donné. !Sur un fond de savon provenant d'une cuve
précédente et à
ébullition, on envoie en
même temps et
à débit mesuré la graisse et
la soude
de telle façon que
la réaction de saponification se
fasse au fur
et à mesure. On fait bouillir le
mélange grâce à la vapeur d'eau qui circule au fond de la cuve dans un
serpentin. Ce procédé est
qualifié de «discontinu» car
on vide la
cuve périodiquement pour récupérer
le savon.
 $
$
a) En s'appuyant
sur le texte,
compléter la légende
du schéma en
associant à chaque
numéro un terme (matériel, substances chimiques). Les
flèches en trait pointillé représentent du matériel alors que les flèches en
trait plein représentent ce qui est introduit.
b) Etant donné ce qui a
été vu en première partie, pourquoi introduit-on « un fond de savon » dans la
cuve ?
c) Par quel moyen le
mélange est-il porté à ébullition ? Quel est l'intérêt de faire bouillir le
mélange ?