Étude cinétique de la dismutation de l'eau
oxygénée (Réunion
2007 )
couples oxydant-réducteur : H2O2 (aq) / H2O(l) et O2 (g) / H2O2 (aq).
Réaction 1
2 H2O2 (aq) = 2 H2O(l) + O2
(g)
Données :
Volume molaire des gaz dans les conditions de l'expérience
: Vm ![]() 25 L.mol-1.
25 L.mol-1.
Partie 1 : Étude de la réaction de dismutation
1. Deux demi-équations
d'oxydoréduction
H2O2 (aq) + 2 H+(aq) + 2 e- = 2 H2O(l) ½ équation de réduction car gain
d’électron
H2O2 (aq) = O2 (g) + 2H+(aq)
+ 2 e- ½
équation d’oxydation car perte d’électron
2. L’oxydant de la demi équation d’oxydation est O2
car il peut gagner des électrons. Le réducteur est l’eau oxygénée car il peut
céder des électrons.
3. Tableau d'évolution du système
|
équation chimique |
2 H2O2(aq) = 2 H2O(l) + O2(g) |
|||
|
État du système |
Avancement (en
mol) |
Quantités de
matière (en mol) |
||
|
État initial |
x = 0 |
n0 (H2O2) |
Solvant |
n0 (O2)= 0 |
|
Etat en cours de transformation |
x |
nt(H2O2) = n0(H2O2) – 2x |
Solvant |
|
|
État final |
xmax |
n(H2O2)
= n0(H2O2) – 2xmax = 0 |
Solvant |
|
Partie 2 : Détermination de la concentration initiale de la
solution de peroxyde d'hydrogène
1.1. Le titre de la solution est 10
volumes. Par conséquent le volume de dioxygène V(O2) qui serait
dégagé est :
V(O2) = 10 L
Quantité de
dioxygène formé au cours de cette transformation :
![]()
1.2.
D ‘après le tableau d’avancement :
![]()
avec V = 1L
n0(H2O2) – 2xmax = 0
n0(H2O2) =
2.xmax
![]()
2. Détermination de la valeur réelle de la concentration
en peroxyde d'hydrogène.
V0 = 10,0 mL de cette solution par
une solution de permanganate de potassium acidifiée de concentration en soluté C1 = 2,0 ´
10 -1 mol.L-1. Les couples oxydant-réducteur
intervenant au cours du titrage sont MnO4– (aq)
/ Mn2+(aq) et O2 (g) / H2O2
(aq). Le volume de permanganate de potassium versé pour obtenir
l'équivalence est Veq =14,6 mL.
L'équation de la réaction de
titrage est la suivante :
Réaction 2
5 H2O2 (aq) + 2 MnO4-
(aq) + 6 h3o+(aq) = 5 O2 (g) + 2 Mn2+(aq)
+ 14 H2O
(l)
2.1.
A l’équivalence les réactifs ont entièrement disparu. Avec une goutte
de plus en ion permanaganate la solution se colore instantanément en violet.
2.2. A l’équivalence les réactifs ont
été introduits dans les proportion stoeochiométriques :
![]()
2.3. Donner l'expression de la
concentration en peroxyde d'hydrogène de la solution
commerciale [H2O2]exp en fonction de C1,
V0 et Veq.
![]()
2.4.
![]()
2.5. Les deux valeurs sont
similaires ;
![]()
La concentration en eau oxygénée a diminué car une
partie c’est dismutée suivant la réaction lente : 2 H2O2 (aq) = 2 H2O(l) + O2
(g)
2.6 Schéma de dosage

 Partie 3 : Étude cinétique de la dismutation du peroxyde
d'hydrogène
Partie 3 : Étude cinétique de la dismutation du peroxyde
d'hydrogène
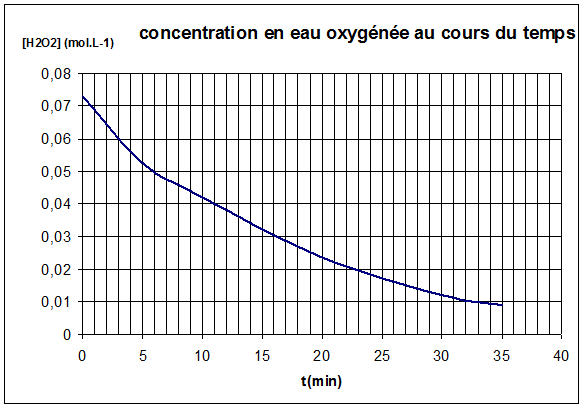
1.
Evolution de
la concentration en peroxyde d'hydrogène en fonction du temps.
2.
Avancement de la transformation x(t)
en fonction de nt(H2O2) :
nt(H2O2) = n0(H2O2) – 2x(t)
![]()