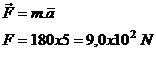HYDROLYSE BASIQUE DES ESTERS
1.
Cinétique de la saponification du méthanoate d'éthyle
On
étudie la cinétique de la réaction d'hydrolyse basique d'un ester, le méthanoate
d'éthyle par la mesure de la conductance du mélange de méthanoate d'éthyle et
de solution d'hydroxyde de sodium NaOH (ou soude) en
fonction du temps.
Protocole expérimental :
On
verse dans un becher une solution d'hydroxyde de
sodium (ou soude) de concentration C0 = 1,00.10 –2 mol .
dm -3.On plonge la cellule conductimétrique dans la solution et on
met en marche l'agitation. On mesure la
conductance initiale G0 à un instant que l'on désigne par t0.On
ajoute alors rapidement le méthanoate d'éthyle, en quantité égale à celle de la
soude initiale. On mesure la conductance de la solution en fonction du temps.
Les mesures sont reportées dans le tableau 1
Tableau
1 : Mesures des conductances et calculs de l'avancement en fonction du temps :
|
t (min) |
0 |
3 |
6 |
9 |
12 |
15 |
45 |
Fin de réaction |
|
G (mS) |
? |
2,16 |
1,97 |
1,84 |
1,75 |
1,68 |
1,20 |
1,05 |
|
Avancement x (mmol) |
0 |
0,46 |
0,72 |
0,90 |
|
1,10 |
1,70 |
2,00 |
Données :
L'équation
de la réaction étudiée est :
HCO2 –
CH2 – CH3 + HO– =
HCO2–
+ CH3 – CH2 –
OH
À
un instant t la conductance du mélange est donnée par la relation :
Gt =
k×( ![]() × [Na+]
+
× [Na+]
+ ![]() × [HO–] +
× [HO–] + ![]() × [HCO2–] )
× [HCO2–] )
avec
k la constante de cellule, k = ![]() = 0,0100 m et l la conductivité molaire
ionique.
= 0,0100 m et l la conductivité molaire
ionique.
Les conductivités molaires ioniques de
quelques ions à 25°C sont données dans le tableau ci-dessous :
|
ion |
Na+(aq) |
HO–(aq) |
HCO2–(aq) |
|
en S.m².mol-1 |
5,01.10 –3 |
19,9.10 –3 |
5,46.10 –3 |
Remarques :
Le
volume de méthanoate d'éthyle est négligeable devant le volume V d'hydroxyde de
sodium.Le volume du mélange est égal à 200 cm3 et la concentration C0
= 1,00.10 –2 mol.dm -3. La solution d'hydroxyde de sodium
étant nettement basique on négligera la présence des ions H3O+
devant les autres ions du mélange réactionnel.
Questions :
Soient n0 la quantité de
matière initiale d'ions hydroxyde et d'ions sodium et n0 la quantité
de matière initiale de méthanoate d'éthyle.
1.1. On considère la solution
d'hydroxyde de sodium de volume V à l'instant t0.
1.1.1. Donner
la concentration des ions dans cette solution à cet instant.
1.1.2. Montrer
que la conductance G0 peut s'écrire : G0 =(k/V).n0
. (![]() +
+
![]() )
(1)
)
(1)
1.1.3. En utilisant les unités conventionnelles du
Système International, calculer la valeur de G0.
1.2. On
note x, l'avancement de la réaction à un instant t. Compléter le tableau
d'avancement qui figure sur l'annexe 2 en indiquant les quantités de matière en
fonction de x. L'annexe
2 est à rendre avec la copie.
1.3. On étudie la conductance de
la solution en fonction du temps.
1.3.1. Montrer que la conductance
du mélange à un instant t en fonction des quantités de matière initiales et de
l'avancement x peut s'écrire :
Gt
= (k/V).[ ![]() . n0 +
. n0 + ![]() . (n0 – x)
+
. (n0 – x)
+ ![]() . x ] (2)
. x ] (2)
On veut montrer que la mesure de la conductance Gt permet de connaître l'avancement x en établissant une relation simple entre Gt et x.
1.3.2. Simplifier l'expression (2) pour montrer qu'on peut
écrire Gt sous la forme Gt = a.x + b (3),
a et b étant des constantes qui contiennent les conductivités molaires ioniques
et les quantités de matière initiales n0.
1.3.3. À quelle grandeur
correspond le coefficient b ? Quel est le signe de la constante a ?
1.3.4 Quelle
serait l'allure de la représentation graphique Gt en fonction de x
(relation (3))
?
1.4. La relation (3) a permis de calculer les
valeurs de l'avancement x qui sont indiquées dans le tableau 1 précédent.
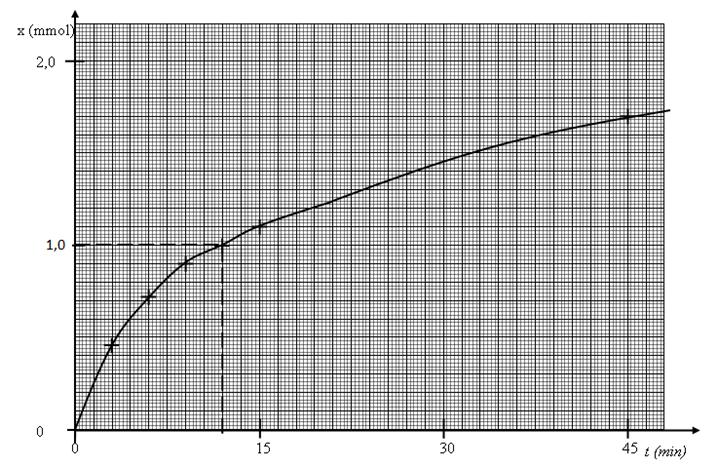
1.4.1
Déterminer la valeur de l’avancement ‘x’ à t = 12 min
1.4.2
Tracer la courbe donnant les variations de x en fonction du temps.
On prendra comme échelle en abscisse 1
cm pour 3 min et en ordonnée 1 cm pour 0,20 mmol.
ANNEXE 2 à rendre avec la copie
Tableau 2 :
Tableau d'avancement
|
équation chimique |
H–CO2–CH2–CH3
+ HO– = HCO2– +
CH3–CH2–OH |
||||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
État initial |
0 |
n0 |
n0 |
0 |
0 |
|
État intermédiaire |
x |
|
|
|
|
Hydrolyse basique des esters (2004/09
Antilles)
1.1.1. H–CO2–CH2–CH3 + HO– = HCO2– +
CH3–CH2–OH
A t = 0 seul les ions Na+ et
HO- sont présents dans la solution.
La réaction de dissolution de la soude dans la
solution est :
NaOH(s) = Na+(aq) + HO–(aq) transformation totale
[HO–(aq)]
= [Na+(aq)] = C0 = 1,00.10–2 mol.L-1 (1dm3
= 1L)
1.1.2.
G0 = k×( ![]() ×[Na+(aq)] +
×[Na+(aq)] + ![]() ×[HO–(aq)]) = k×C0×(
×[HO–(aq)]) = k×C0×( ![]() +
+ ![]() )
)
G0 =
![]() n0 (
n0 ( ![]() +
+ ![]() )
)
1.1.3. Calcul de Go
G0 = k×C0×( ![]() +
+ ![]() )
)
Attention
les concentrations sont dans l’unité légale : C0 en mol.m–3,
1 mol.L-1
= 1 mol/(10-3 m3)
Co = 1,00.10–2 mol/L = 1,00.10–2 /( 10-3
m3) = 1,00x101 mol.m-3
G0
= 0,0100×1,00.101 ´(5,01.10–3 + 19,9.10–3)
G0 = 0,0100×1,00.10–2 ´(5,01+19,9) = 2,49 mS
|
1.2. équation
chimique |
H–CO2–CH2–CH3 + HO– = HCO2– +
CH3–CH2–OH |
||||
|
État du système |
Avancement
(mol) |
Quantités de
matière (mol) |
|||
|
État initial |
0 |
n0 |
n0 |
0 |
0 |
|
État
intermédiaire |
x |
n0 – x |
n0 – x |
x |
x |
1.3.1. La conductance de la solution à l’instant t est :
Gt = k ×( ![]() ×[Na+(aq)] +
×[Na+(aq)] + ![]() ×[HO–(aq)] +
×[HO–(aq)] + ![]() ×[HCO2-(aq)] )
×[HCO2-(aq)] )
Gt = k ×( ![]() ×
×![]() +
+ ![]() ×
×![]() +
+ ![]() ×
×![]() )
)
Gt= ![]() ×(
×( ![]() ×n0 +
×n0 + ![]() ×(n0 – x) +
×(n0 – x) + ![]() ´ x)
´ x)
1.3.2. Gt= ![]() ×(
×( ![]() ×n0 +
×n0 + ![]() ×(n0 – x) +
×(n0 – x) + ![]() ´ x)
´ x)
Gt = ![]() ×
× ![]() × n0 +
× n0 + ![]() ×
× ![]() × n0 –
× n0 – ![]() ×
× ![]() ´ x +
´ x + ![]()
![]() ´ x
´ x
Gt= ![]() .x (
.x (![]() –
– ![]() ) +
) +![]() ×n0 (
×n0 ( ![]() +
+ ![]() )
)
Gt = ax + b
a = ![]() ×(
×(![]() –
– ![]() )
)
b = ![]() ×n0 (
×n0 ( ![]() +
+ ![]() )
)
1.3.3.
G0
= k×C0×( ![]() +
+ ![]() )
)
b = ![]() ×n0 (
×n0 ( ![]() +
+ ![]() )
)
b = G0
|
ion |
Na+(aq) |
HO–(aq) |
HCO2–(aq) |
|
en S.m².mol-1 |
5,01.10 –3 |
19,9.10 –3 |
5,46.10 –3 |
![]() >
> ![]()
a = ![]() –
– ![]()
donc a < 0
1.3.4. Gt = a.x + b
La représentation de Gt en
fonction de x serait une droite de pente négative et
qui ne passe pas par l’origine ( pour x = 0 , G0 = b ).
1.4.1. Calcul de x à
t = 12 min, G = 1,75 mS
Gt= ![]() .x (
.x (![]() –
– ![]() ) +
) +![]() ×n0 (
×n0 ( ![]() +
+ ![]() )
)
Gt -
![]() ×n0 (
×n0 ( ![]() +
+ ![]() ) =
) = ![]() .x (
.x (![]() –
– ![]() )
)
[Gt.V/k
- n0 ( ![]() +
+ ![]() )] /(
)] /(![]() –
– ![]() ) = x
) = x
A.N.
x = 1,00x10-3
mol
1.4.2. Avancement x de la réaction de saponification du méthanoate d'éthyle en fonction du temps.
![]()
RECORD DE SAUT EN LONGUEUR À MOTO
(Polynésie 09/2009)
La phase d’accélération du motard.
![]()
 1.
échelle1 cm (document) Û
2 m (réel)
1.
échelle1 cm (document) Û
2 m (réel)
G1G3 = 6,4 cm sur le
document donc G1G3 (réel) = 6,4 × 2 / 1 = 12,8 m
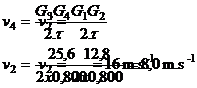
G3G5 = 12,8 cm sur le document donc G3G5
(réel) = 12,8 × 2 / 1 = 25,6 m
2.
Échelle des vitesses : 1 cm Û 2 m.s-1 donc
les longueurs des vecteurs viteses sont :
L(![]() ) = 8,0 × 1/2 = 4,0 cm
) = 8,0 × 1/2 = 4,0 cm
L(![]() ) = 16,0 × 1/2 = 8,0 cm
) = 16,0 × 1/2 = 8,0 cm
Rappel : Les vecteurs vitesses sont tangents à
la trajectoire et orientés dans le sens du mouvement.
3.
![]() =
= ![]() –
– ![]()
Le vecteur variation de vitesse démarre du point G3.
4.
Vecteur accélération ![]() au point G3 :
au point G3 :
![]()
![]() .
.
![]()
1 cm Û
2 m.s-1 ;
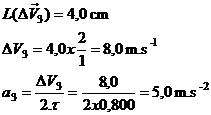
5.1.
la vitesse est proportionnelle au temps car
Le graphe de la figure 2 est une droite qui passe par l’origine,
v = k.t avec k pente de la courbe
L’accélération a est défini par :
a = ![]() ;
;
a = ![]() = k
= k
L’accélération de la moto est constante.
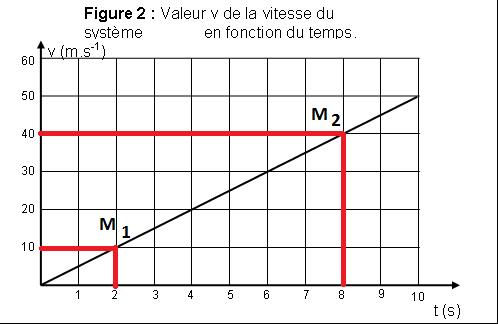 5.2.
Pour déterminer
l’accélération il faut calculer la
pente de la courbe v = f(t) . On prend 2
points de la droite :
5.2.
Pour déterminer
l’accélération il faut calculer la
pente de la courbe v = f(t) . On prend 2
points de la droite :
entre les points
M1 (t1 = 2 s ; V1
= 10 m.s-1)
M2
( t2 = 8 s ; V2 = 40 m.s’1)
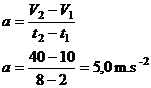
On retrouve bien la valeur obtenue graphiquement en 4.
5.3. v = 160 km/h = 160x1000/3600
v = 44,4 m.s-1
v = a.t
t = v/a = 44,4/5,0
t = 8,9 s
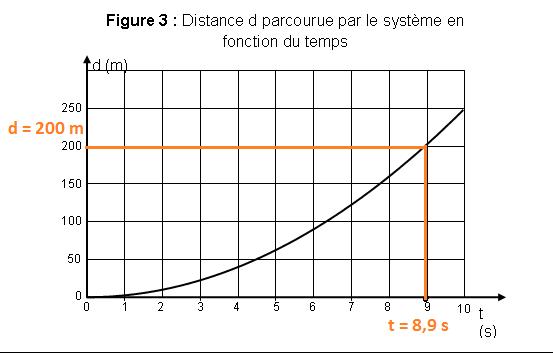
A t = 8,9 s la moto attaint la vitesse de 44,4 m.s-1
Graphiquement avec d = f(t) on trouve la distance
parcourue par la moto quand elle atteint la vitesse v = 160 km/h
d
= 200 m
6.1 vidéo
Lorsqu'un système matériel A exerce une force
sur un système matériel B, alors celui-ci exerce sur le système matériel A une
force opposée :
![]()
Les droites d'actions des
2 forces sont confondues.
6.2 D’après le principe d’interaction la force
exercée par la moto sur la route est opposée à la force exercée par la route
sur la moto :
![]()
6.3
c) Pour faire l'étude mécanique du
système, il faut toujours définir dans l'ordre:
1) Le système: (moto, motard)
2) Le référentiel : la terre supposée référentiel galiléen, dans lequel
on pourra appliquer la seconde loi de Newton.
3) Le repère lié au référentiel :
![]()
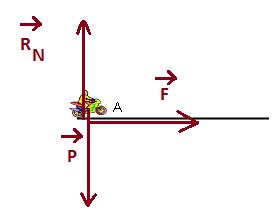
4) Somme des forces extérieures au système :
![]()
Les vecteurs poids et réaction normale au
poids sont opposés.
6.4 Tracé des vecteurs forces :
6.5