Chapitre 3 : vitesse de réaction
Suivi spectrophotométrique d'une réaction corrigé
L'énergie
lumineuse absorbée par une espèce colorée dépend de la longueur d'onde
utilisée. Un spectrophotomètre, une fois réglé, donne une mesure de cette absorption
par l'intermédiaire d'une grandeur numérique sans dimension : l'absorbance A.
En général, l'absorbance est proportionnelle à la concentration molaire de
l'absorbant : A= k.C .
Un
technicien veut suivre au spectrophotomètre la réaction en milieu acide entre
les ions MnO4- (qui donnent à la solution une couleur
violette) et les molécules (incolores) d'acide oxalique H2C2O4.
Q1
a) Il
place dans le spectrophotomètre une cuve contenant : V1= 1,0 mL de
permanganate de potassium (K+, MnO4- ) de
concentration C1= 2,0 x 10-3 mol.L-1, V2=
0,5 mL d'acide sulfurique de concentration C2= 0,5 mol.L-1
et V3= 1,0 mL d'eau. Cette cuve est traversée par un faisceau
lumineux adéquat.
L'appareil
délivre la courbe (a), de la figure ci-après représentative des valeurs
d'absorbance au cours de temps.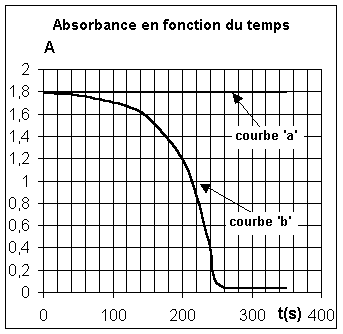
b)
Pierre dit qu'il faut envoyer un rayonnement de longueur d'onde l
=700 nm (correspondant à une radiation de couleur rouge). Marie pouffe de rire et
lui dit qu'il faut utiliser plutôt une radiation de couleur violette Lequel a
le plus de chances d'avoir son bac ?
c)
Déterminer la valeur du coefficient k.
Il
remplace la cuve par une autre contenant V1 = 1 mL de permanganate
de potassium à
c)
Démontrer que l'acide oxalique est l'espèce réductrice de l'équation bilan.
Q3
a)
Donner la définition de la vitesse volumique 'v' de la réaction.
c) Exprimer
la vitesse volumique de disparition des ions permanganates en fonction de
'v'.
![]()
![]() .
.
Q4
Le
spectrophotomètre calcule aussi la dérivée de l'absorbance A, et fournie la
grandeur X définie par :
![]()
|
t (s) |
100 |
130 |
150 |
170 |
190 |
195 |
200 |
205 |
210 |
|
X (min-1) |
9,7 |
13,4 |
37,4 |
53,9 |
63,0 |
75,0 |
84,6 |
101 |
a) Exprimer
X en fonction de la vitesse v.
b)
Expliquer comment on peut évaluer numériquement X à une date donnée à partir de
la courbe (b) de la figure 1 : Compléter la case vide du tableau puis calculer
v au même instant.
c)Au vu
du tableau, dire comment évolue la vitesse v au cours du temps.
Q5
Ici un
des produits de la réaction, l'ion manganèse Mn2+, catalyse la
réaction.
b) Deux
paramètres antagonistes d'évolution de la vitesse v entrent en compte : L'un est
la concentration en catalyseur (dont l'augmentation permet d'accélérer la
réaction). Quel est l'autre ?