DETERMINATION DE LA CONSTANTE D'ACIDITÉ D'UN INDICATEUR
COLORÉ : LE VERT DE BROMOCRÉSOL (Amérique du Sud 2006 4 points)
Le vert de bromocrésol est un indicateur coloré acido-basique. C'est un
couple acide-base dont l'acide HInd et la base Ind–
possèdent deux couleurs différentes : la forme acide est jaune tandis que la
forme basique est bleue. Le but de
cet exercice est de déterminer la valeur de la constante d'acidité du vert de
bromocrésol par deux méthodes différentes.
1. Détermination de la
constante d'acidité du vert de bromocrésol par pH-métrie.On dispose d'une solution commerciale S de
vert de bromocrésol à 0,02 % en solution aqueuse. La concentration molaire en soluté apporté de
cette solution est c = 3,0 ´ 10 – 4 mol.L–1 . Après
avoir étalonné un pH-mètre, on mesure le pH d'un volume V = 100,0 mL de la
solution S, on trouve un pH égal à 4,2.
1.1. Écrire l'équation de la réaction de l'acide HInd avec l'eau.
1.2. Dresser un tableau d’avancement en mol.L-1.
1.3. Calculer la valeur de l'avancement final xf de la réaction entre l'acide HInd et l'eau.
1.4. Calculer le taux d'avancement final t de cette réaction. La
transformation de l'acide HInd avec l'eau. est-elle totale ?
1.5. Établir l'expression de la constante d'acidité KA de
l'indicateur en fonction du pH de la solution et de la concentration molaire en soluté apporté c de la solution S.
1.6. Calculer la valeur de KA . En déduire la valeur du pKA
du vert de bromocrésol.
2. Détermination de la
constante d'acidité du vert de bromocrésol par spectrophotométrie.
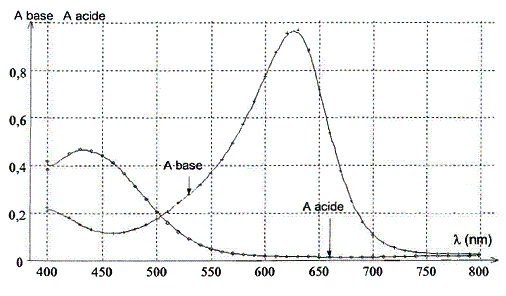 À l'aide d'un spectrophotomètre, on relève
l'absorbance des formes acide et basique du vert de bromocrésol. On obtient les courbes suivantes
:
À l'aide d'un spectrophotomètre, on relève
l'absorbance des formes acide et basique du vert de bromocrésol. On obtient les courbes suivantes
:
2.1.À quelle longueur d'onde l faut-il
régler le spectrophotomètre afin que l'absorbance de la forme acide soit quasiment
nulle et celle de la forme basique du vert de bromocrésol soit maximale ?
2.2.On utilise seize solutions de volumes identiques mais de pH différents
dans lesquelles on ajoute le même volume de la solution commerciale S de vert
de bromocrésol. Après avoir réglé le spectrophotomètre, on mesure l'absorbance de ces seize solutions
(résultats voir tableau).
|
Solution
n° |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
pH |
1,5 |
2,4 |
2,9 |
3,1 |
3,3 |
3,8 |
4,3 |
4,6 |
|
Absorbance |
0 |
0 |
0,013 |
0,032 |
0,036 |
0,094 |
0,206 |
0,382 |
|
Teinte de la solution |
jaune |
jaune |
jaune |
jaune |
jaune |
verte |
verte |
verte |
|
Solution n° |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
pH |
5,0 |
5,3 |
6,2 |
6,7 |
7,0 |
8,4 |
9,2 |
10,0 |
|
Absorbance |
0,546 |
0,746 |
0,790 |
0,886 |
0,962 |
0,970 |
0,970 |
0,970 |
|
Teinte
de la solution |
verte |
verte |
bleue |
bleue |
bleue |
bleue |
bleue |
bleue |
À partir des mesures du tableau précédent, il est possible de calculer les
pourcentages de forme acide et de forme basique présentes dans chacune des
seize solutions et ainsi de construire le diagramme de distribution des espèces
du couple HInd/Ind–.

2.2.Rappeler la relation
entre le pH le pKA et les concentrations [HInd] et [Ind –]. En quel point
du diagramme de distribution des espèces a-t-on [HInd] = [Ind –] ?
En déduire la valeur du
pKA du vert de bromocrésol.
2.3.Tracer le diagramme
de prédominance du couple HInd/Ind –.
2.4.Évaluer, à l'aide du
tableau, l'intervalle des valeurs de pH
pour lesquelles le vert de bromocrésol prend sa teinte
intermédiaire entre la forme acide et basique (teinte appelée teinte sensible).
Comment appelle-t-on cet intervalle ?
On considère que le vert de bromocrésol prend sa
teinte acide lorsque ![]() > 10 et qu'il prend sa teinte basique lorsque
> 10 et qu'il prend sa teinte basique lorsque ![]() > 10.
> 10.
2.5. Déterminer par le calcul l'intervalle de pH pour lequel l’indicateur coloré prend sa teinte sensible. Comparer cet intervalle à celui évalué précédemment.
2.6. A l’aide de la relation liant le pH le pKA et les
concentrations en acide et base, déterminer la valeur du pH quand les
pourcentages en acide et base sont : p(HInd) = 10% et p(Ind-) =
90%. Retrouver ce résultat à l’aide du diagramme de distribution des espèces.