Chapitre
6 : réactions acido-basiques titrage
DU CHOU DANS L'abricot (4 points Antilles 09-2007) corrigé
Note
à l'attention du candidat : les parties 1
et 2 sont indépendantes.
Les
anthocyanes sont des colorants naturels présents dans de nombreux fruits rouges
ou de pétales de fleurs.Ils sont notamment présents dans les feuilles de chou
rouge d'où il est aisé de les extraire. La variation de structure des
anthocyanes en fonction de l'acidité du milieu est une particularité de ces
molécules. Suivant le pH, 3 formes, avec des absorbances différentes, ont été
mises en évidence (voir ANNEXE 3).On souhaite utiliser le jus de chou
rouge comme indicateur pour doser l'acide propanoïque (CH3-CH2-COOH)
utilisé dans la synthèse de l'arôme d'abricot.Afin de vérifier que
l'utilisation du jus de chou rouge est judicieuse, un premier dosage à la date
t = 2 min est réalisé par pH-métrie
(voir ANNEXE 4). Acide propanoïque (CH3-CH2-COOH)
ion propanoate CH3-CH2-CO2-
1. ÉTUDE DU DOSAGE
1.1.
Écrire l'équation
bilan traduisant le titrage de l'acide propanoïque par une solution d'hydroxyde
de
sodium (Na+aq + HO–aq).
1.2.
Déterminer, en faisant apparaître les
constructions sur la courbe de L'ANNEXE 4, le volume V et le pH à l'équivalence. Décrire la méthode utilisée.
1.3.
Quelle est la couleur de la solution initiale
une fois le jus de chou rouge introduit ? Justifier votre réponse à l'aide des
documents donnés dans les ANNEXES 3 et 4.
1.4.
Le chou rouge
peut-il être utilisé comme indicateur coloré dans ce dosage ? Justifier la
réponse.
1.5.
Utilisation de la
courbe pour déterminer la constante d'acidité de l'acide propanoïque :
1.5.1.
Donner
l'expression de la constante d'acidité de l'acide propanoïque.
1.5.2.
Que peut-on dire des concentrations en acide
propanoïque et en ion propanoate lorsque la moitié du volume équivalent a été
versé ? Exprimer les concentrations de l’acide et de la base à la demi
équivalence. Le nombre de mole d’acide initiale sera noté n(AH)initiale
, le volume d’acide sera noté Va et le volume équivalent VE.
1.5.3.
Donner alors l'expression de la constante
d'acidité de l'acide propanoïque en fonction du pH lorsque la moitié du volume
équivalent a été versé.
1.5.4.
À partir de la valeur du pH lue sur la courbe à la demi équivalence, déterminer
la valeur de la constante d'acidité de l'acide propanoïque.
Les anthocyanes du chou rouge sont utilisés dans la
suite pour réaliser les dosages de l'acide propanoïque par colorimétrie.
2. SUIVI TEMPOREL DE LA SYNTHÈSE.
De
l'arôme d'abricot est synthétisé à chaud à partir du mélange d'un volume VA
= 20,0 mL d'alcool noté A et d'un volume VB
= 29,0 mL d'acide propanoïque (CH3CH2CO2H)
en présence de 1,0 mL d'acide
sulfurique. On note VT = 50,0 mL le
volume total du système. Les réactifs sont introduits à la date t = 0. Les données utiles à la résolution de
l'exercice sont données dans L'ANNEXE 5 (à rendre avec la copie).
La réaction chimique appelée réaction d’estérification supposé totale a pour
équation :
C2H5CO2H
+ C5H12O = C8H16O2 + H2O
Afin
de suivre l'évolution de cette transformation en fonction du temps, des prises
d'essai de volume V'B = 3,0
mL sont réalisées à intervalles de temps réguliers. Une trempe de chaque prise
d'essai est effectuée dès son prélèvement ; cette opération consiste à
ajouter une grande quantité d'eau distillée glacée à la prise d'essai. Les
acides (acide sulfurique et acide propanoïque restant) sont dosés par une
solution d'hydroxyde de sodium de concentration C = 1,0 mol.L-1 en présence de jus
de chou rouge.
2.1.
Expliquer
l'intérêt de la trempe en précisant le(s) facteurs) cinétique(s) mis enjeu.
2.2.
Déterminer la
quantité de matière d'acide propanoïque nB(0) introduite à la date t = 0. La quantité de matière initiale d'alcool A est nA(0)
= 18.10-2 mol.
2.3.
Déterminer
l'avancement maximum de la transformation chimique.
2.4.
Établir la relation
entre la quantité nB d'acide
restant à la date t, la quantité nB(0) et l'avancement x de la
transformation à cette date.
2.5.
Dans le tableau
suivant sont reportés les volumes de réactif titrant versés pour doser
uniquement l'acide propanoïque :
|
t (min.) |
0 |
2 |
5 |
10 |
15 |
20 |
25 |
30 |
|
V(mL) |
23,3 |
- |
17,8 |
14,8 |
13,7 |
13,3 |
13,0 |
13,0 |
V étant le volume de réactif titrant ajouté à
l'équivalence dans la prise d'essai de volume V'B.
Déterminer la quantité n’B d'acide
propanoïque présent dans la prise d'essai à la date t = 30 min.
En déduire la quantité nb d'acide propanoïque restant dans le milieu réactionnel de
volume VT =
50,0 mL.
2.6. Le taux d’avancement noté t
(tau) d’une réaction chimique étant défini à la date t comme le rapport de
l’avancement à la date t sur l’avancement maximal de la réaction, déterminer le
taux d’avancement de la transformation étudiée à la date t = 30 min.
2.7. Après avoir placé sur la courbe de l’ANNEXE 6 (à rendre avec la copie) la
valeur déterminée dans la question
2.5., tracer la courbe donnée en ANNEXE 6. Peut-on considérer que la transformation est terminée
après 30 minutes de chauffage à reflux ? Justifier.
2.8. Définir et déterminer le temps de demi-réaction.
2.9 On a préparé la solution de soude de concentration
c = 1,0 mol.L-1 de volume V =0,1 L avec une solution commerciale de
densité d = 1,2 avec un pourcentage en masse d’hydroxyde de sodium de 33%.
Calculer la concentration c1 en soude de la solution commerciale. Détailler
comment préparer la solution de concentration c à partir de la solution
commerciale. M(NaOH) = 40 g.mol-1.
ANNEXE 3
Les
anthocyanes du chou
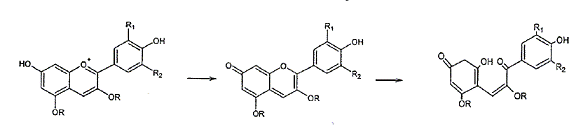
Cation Flavylium Base quinonique Chalcone
Espèces chimiques
|
Cation Flavyliun Base Quinonique |
Chalcone |
||
|
pH |
3,0
6 8,5 13 |
|||
|
Couleur |
rouge |
Bleu
vert |
Vert
|
Jaune |
ANNEXE 5
réactifs et produits de la synthèse
|
|
M en g.mol-1 |
Masse volumique à 20°C en
g.mL-1 |
Température de fusion en °C |
Température
d'ébullition en °C |
Solubilité avec l'eau |
|
Acide propanoïque |
74,0 |
0,99 |
-20,8 |
141 |
infinie |
|
Alcool A |
88,2 |
0,81 |
-117 |
128,5 |
faible |
|
Éthanoate d'isoamyle |
130,2 |
0,87 |
-78,5 |
142 |
faible |
ANNEXE
4 (à rendre avec la copie)

ANNEXE
6 (à rendre avec la copie)
Évolution du taux d'avancement en fonction du temps
