Alexi
BOUCHET
Hélène
PERBET
Valérie
ZINCK

1 La sécurité au laboratoire page
2
2 Le matériel page
7
3 Préparation de solution page
8
4 Consignes pour les
séances de T.P. -Comptes-rendus et examen- page 10

1 - Hydrotimétrie page
11
2 - Etude cinétique( réaction de l’eau
oxygénée sur les ions iodure) page 13
3 - Manganimétrie page
14
4 - Détermination d’un produit de solubilité
par potentiométrie.
page 16
5 - Dosage redox page
17
6 - Dosage pH-métrique page
18
A Consignes pour les séances de T.P.
LA SECURITE
|
|
1 /
Principales règles de sécurité au laboratoire
Affichage de sécurité et matériel de protection
général
On doit
connaître l'emplacement et le mode de fonctionnement des exctincteurs , de la douche d'urgence , des bains oculaires , de la
couverture ignifugée et de la trousse de premiers soins . Enfin il est
essentiel de connaître l'emplacement des sorties
d'urgence et des dispositifs d'alarmes.
Comportement au laboratoire
Il faut être
attentif et éviter tout comportement irréfléchi ou précipité.
Ne pas courir.
Ne jamais conserver ou
consommer des aliments ou des boissons dans un laboratoire.
Ne jamais fumer.
Tenir fermés les tiroirs et
les portes d'armoires.
Garder les allées libres .
Assécher immédiatement les
endroits mouillés.
Ne jamais travailler seul.
En quittant les locaux :
fermer la vanne générale d'arrivée de gaz et couper le courant électrique.
Protection personnelle
Protection oculaire
On doit
toujours porter des lunettes de sécurité . Les verres de contact ne devraient
pas être portés au laboratoire: Des vapeurs organiques ou corrosives peuvent
les endommager de façon irréversible ou s'infiltrer sous la lentille.
Habillement
Les blouses doivent être en tissu de coton résistant et équipées de
boutons pression , ce qui permet de les enlever rapidement si nécessaire ;
elles doivent être assez longues pour protéger les jambes.
Préférer les
pantalons longs aux jupes.
Attacher les
cheveux
Porter des
chaussures qui recouvrent entièrement le pied.
Gants
Le port de
gants peut être recommandé ou indispensable pour certaines manipulations ,
telles que celles de : produits corrosifs
produits très toxiques par voie cutanée
récipients très chauds ou très froid
Projection sur
une personne
Si les projections s'étendent
sur une grande partie du corps , utiliser immédiatement la douche de sécurité
et retirer les vêtements contaminés. La région affectée doit être arrosée avec
de l'eau froide pendant environ 15 minutes.
Si les projections
n'affectent qu'une petite surface de la peau , rincer abondamment à l'eau
froide puis à l'eau savonneuse ; retirer les bijoux qui nuisent à l'élimination
des produits chimiques pendant le nettoyage.
Dans le cas d'une projection
dans les yeux , laver immédiatement l’œil avec de l'eau pendant au moins 15
minutes à l'aide du bain oculaire .
Marche à suivre
en cas d'accident
Protéger la victime
Tenter d'éliminer le danger
s'il persiste un risque ( électrocution , incendie , asphyxie)
Appeler de l'aide
Si la personne blessée est inanimée , la
soustraire au danger , l'examiner et lui prodiguer les soins élémentaires (
respiration artificielle , garrot , etc ...) pendant qu'on fait alerter le
personnel compétent qui prendra la personne blessée en charge .
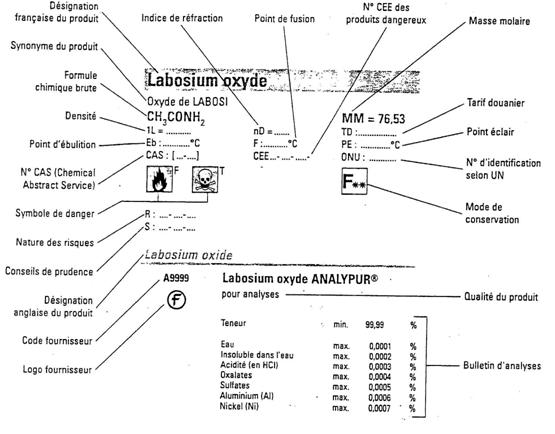
Etiquetage
Les flacons et
récipients contenant des produits chimiques doivent être clairement étiquetés
pour faciliter leur identification. Dans le cas de produits préparés au
laboratoire , la date de leur fabrication doit être indiquée . Pour les
produits commerciaux , il est recommandé de marquer la date de leur arrivée.


Exemple d’étiquette
De façon
générale, les produits chimiques sont fournis sous les appellations
suivantes :
P
Techniques (10 à 20 % d’impuretés)
P
Purs (moins de 5 % d’impuretés)
P
Pour analyses (le taux des impuretés est
précisé sur l’étiquette).
En France,
l’étiquetage conventionnel est le suivant :
Ä
Etiquette blanche : produits non
dangereux
Ä
Etiquette verte : produits dangereux
Ä
Etiquette rouge : poisons
2 / Risques inhérents aux produits chimiques
Pour évaluer les précautions à
prendre dans la manipulation d'un produit , il faut prendre en compte non
seulement sa toxicité ou sa réactivité , mais aussi :
Sa volatilité : à
toxicité égale , le risque d'atteindre la VLE (valeur limite d'exposition) dans l'air
inhalé est
évidement d'autant plus grand que le produit est plus volatil.
Si le produit est en solution
, sa concentration , surtout pour les produits corrosifs ou trés réactifs.
Les quantités mises en jeu .
2.1 / Les dangers des
produits chimiques
Les dangers ,
plus ou moins élevés , que présentent les produits chimiques sont les suivants:
Intoxication , brûlure ,
irritation
feu
explosion
Comment
une substance dangereuse peut-elle entrer en contact avec l'organisme ?
1 L'ingestion est la voie la
plus direct . C'est aussi celle qui est prévenue le plus facilement . Voici
donc les impératifs à respecter:
Ne
jamAis gouter UN PRODUIT CHIMIQUE
eviter
de laisser ouverts inutilement des recipients contenant des
produits chimiques.
NE
JAMAIS CHAUFFER UN RECIPIENT HERMETIQUEMENT FERME .
NE JAMAIS PIPETER A LA BOUCHE ( utiliser des
poires propipettes )
Ne jamais conserver ou
consommer des aliments ou des boissons
dans un laboratoire.
2 L'inhalation des
vapeurs de composés toxiques est aussi une voie de pénétration dans l'organisme
. Ceci concerne les gaz et les liquides
volatils. Le danger est double . D'une part , des composés irritants et
corrosifs peuvent léser les voies aériennes supérieures (nez , trachée , artère
, ...) et les poumons
( exemples :
HCl , Cl2 , SO2 , les amines légères). D'autre part , les
composés toxiques atteignent les alvéoles pulmonaires , passent dans le sang et
se répandent dans l'organisme. Il faut donc:
TRAVAILLER DANS UNE PIECE BIEN AEREE
CONDUIRE LES EXPERIENCES DELICATES SOUS LA HOTTE BIEN VENTILEE
NE JAMAIS TENTER DE RECONNAITRE UN PRODUIT A
SON ODEUR
. Un produit détectable à son
odeur est en concentration excessive dans le laboratoire.
3 Le contact direct avec
l'organisme (peau , yeux) présente aussi de graves dangers. D'une part certains
produits sont hautement corrosifs et détruisent rapidement les tissus vivants .
2.2 / Les incompatibilités entre
produits chimiques
|
Substance
|
Incompatibles avec
|
|
Ethyne
(acétylène)
|
Chlore
, brome , fluor , cuivre , argent , mercure
|
|
Acide
éthanoïque (acide acétique)
|
Oxyde
de chrome VI,acide nitrique,acide perchlorique, peroxydes , permanganates ,
composés
hydroxylés , éthylène glycol
|
|
Acide
chromique
|
Acide
acétique , naphtalène , camphre , glycérine , térébenthine , alcool et
liquides inflammables
|
|
Acide
cyanhydrique anhydre
|
Acide
nitrique et alcalis
|
|
Acide
fluorhydrique
|
Ammoniac
(gaz ou en solution)
|
|
Acide
nitrique concentré
|
Acide
acétique , aniline , acide chromique , acide cyanhydrique , sulfure
d'hydrogène , liquides et gaz inflammables
|
|
Acide
oxalique
|
Mercure
et argent
|
|
Acide
perchlorique
|
Anhydride
acétique , bismuth et ses alliages , alcool , papier , bois
|
|
Acide
sulfurique
|
Chlorates
, perchlorates et permanganates de potassium
|
|
Ammoniac
(gaz)
|
Mercure
, chlore , hypochlorite de calcium , iode , brome , acide fluorhydrique
anhydre
|
|
Aniline
|
acide
nitrique , eau oxygénée
|
|
Argent
|
Acétylène
, composés ammoniacaux , acide oxalique , acide tartrique
|
|
Baryum (dioxyde de ...)
|
Alcools
méthyliques et éthyliques , acide acétique glacial , anhydride acétique , bases
, aldéhydes , sulfure de carbone , glycérine , éthylène glycol , acétate de
méthyle , furfural.
|
|
Brome
, chlore et iode
|
Ammoniac
, acétylène , butadiène , méthane ,propane , butane (ou autres gaz de
pétrole),hydrogène, éther de pétrole , benzène , carbure de sodium ,
térébenthine , poudres métalliques
|
|
Chlorates
|
Sels
d'ammonium , acides ,poudres métalliques,soufre, substances organiques
inflammables
|
|
Chrome
VI , oxyde
|
Acide
acétique , naphtalène , glycérine
,éther de pétrole, alcool , liquides inflammables .
|
|
Cuivre
|
Acétylène
, eau oxygénée
|
|
Cyanures
|
Acides
,
|
|
Fluor
|
Doit
être isolé de tous les autres produits
|
|
Hydrocarbures
|
chlore
, brome , iode , acide chromique , peroxyde de sodium
|
|
Hydrogène
, peroxyde
|
Métaux
et sels métalliques , alcools , acétone , aniline , nitrométhane , substances
inflammables ,
|
|
Mercure
|
Acétylène
, ammoniac
|
|
Métaux
alcalins
|
Tétrachlorure
de carbone, Hydrocarbures halogénés, eau, dioxyde de carbone , halogènes
|
|
Nitrate
d'ammonium
|
Acides
, poudres métalliques , liquides inflammables , chlorates , nitrites ,
sulfures , produits combustibles organiques finement divisés.
|
|
Permanganate
de potassium
|
Glycérine
, éthylène glycol , benzaldéhyde , acide sulfurique.
|
2.3 / Quelques sites utiles
INRS :Institut National de Recherche et de Sécurité pour la prévention
des accidents du travail et des maladies professionnelles.
www.inrs.fr
CRAM - Caisse Régionale d'Assurance Maladie du Sud-Est : pour la
retraite (!!!), les données sociales, la santé,
www.cram-sudest.fr
Informations
sur la sécurité : toxicité,fiches de
sécurité, toxicité
des produits chimiques, maîtrise du risque, panneaux d'interdiction. ...
www.ac-nancy-metz.fr/
B Consignes pour les séances de T.P.
LE MATERIEL
|
|
Nous allons
juste préciser l’usage des principaux ustensiles que vous allez rencontrer.
Le terme
général de verrerie recouvre en fait une grande variété de récipients utilisés
dans les laboratoires mais ces récipients ne sont pas forcément en verre.
a a) Les récipients à réaction
2 - relation
entre masse molaire et masse pesée
nombre de mol
masse pesée masse molaire
en g en g/mol
|
 m
= M x n m
= M x n
|
solution molaire = solution à 1 mol/L
solution décimolaire = solution à 0,1 mol/L
solution centimolaire = solution à 0,01 mol/L
solution concentrée = pas de concentration définie
3 - Préparation
de solutions à partir d'un solide
1- déterminer la masse à peser en utilisant la relation
avec:
m =
.............................................................
C =
.............................................................
V =
.............................................................
Ex: Préparer 50 mL d'une solution d'iodure de
potassium à 0.2 mol/L sachant que la masse molaire de KI est de 166 g/mol.
La
masse à peser est de : m = 0.2 x 166 x (
50 x 10-3 ) = 1,66 g
FMM
M
Si le produit est hydraté, il faut
tenir compte de la masse d'eau apportée .MMME
2- dans une fiole jaugée introduire un peu de solvant
, en général de l'eau.
3- Introduire le solide pesé avec précision à l'aide
d'un entonnoir que l'on rincera avec le solvant.
4- Ajouter ,
si nécessaire pour la préparation , de l' acide ou de l'alcool ou autres
substances.
5- Compléter au trait de jauge avec le solvant.
4 - Préparation de solutions à partir d'une solution plus
concentrée : DILUTION
1- déterminer le volume à prélever
A partir d'une solution mère Sm de concentration Cm
, préparer une solution fille Sf de concentration Cf.
On utilise la relation: 
2- à l'aide d'une pipette jaugée,
prélever un volume Vm de solution mère.
3- dans une fiole jaugée de volume Vf
introduire un peu de solvant , en général de l'eau.
4- introduire la prise d'essai dans la fiole jaugée.
5- Compléter au trait de jauge avec le solvant.
5 - Le matériel
X
doit être prélever avec une pipette jaugée ( en général , on utilise 10
ou 20 mL).
Dans le
montage ci-contre , il n'apparaît pas l'appareillage de mesure que l'on peut
utiliser (pH-mètre, conductimètre ou voltmètre)
D Consignes pour les séances de T.P.
Comptes-rendus et examen
|
La préparation du TP
ela
liste du matériel et des produits nécessaires à partir de l’énoncé du TP
e
but du TP
e
la ou les équations bilans mise (s) en
jeu
e
masse (s) théorique(s) à calculer
e
le(s) schéma(s) simplifié(s) du (des) montage(s)
En arrivant en TP
PMettre
la blouse
PComparer
votre liste avec ce qui est présent sur la paillasse.
Chaque compte-rendu de TP doit comporter les différents éléments suivants.
e but du TP
e la ou les équations
bilans mise (s) en jeu
e masse (s) théorique(s) et
pratique(s)
e le(s) schéma(s)
simplifié(s) du (des) montage(s)
e Commentaires et
conclusions pour chaque expérience.
Chaque graphe doit comporter :
e un titre écrit en toutes
lettres (et non une formule mathématique)
e l’échelle qui doit être
pratique (et non un multiple de 3,658 !)
e Les unités en ordonnée et
en abscisse.
e Tous les points
expérimentaux .
L’examen de TP :
P Epreuve individuelle
P durée de deux heures.
P vous avez droit à vos
propres comptes-rendus.
1-HYDROTIMETRIE
I – Principe.
HOOC-CH2 CH2-COOH
N-CH2-CH2-N
HOOC-CH2 CH2-COOH
|
L'hydrotimétrie
est une méthode de détermination de la quantité de sels de calcium et de
magnésium d'une eau par dosage complexométrique.
Certains composés tels que l'EDTA
(éthylènediaminetétraacétique) surtout sous la forme de son sel disodique forment des chélates (ou complexes) avec des
ions métalliques tels que les alcalino- terreux et certains métaux lourds.
La stabilité des complexes formés dépend du pH, ce qui
permet un dosage sélectif en faisant varier les conditions d'acidité.
Il y a compétition entre la dissociation du complexe et la
dissociation acide. En milieu très basique tous les complexes avec l’EDTA se
forment facilement mais il peut se former des précipités d’hydroxydes.
Selon la méthode, on peut doser soit la somme des ions
calcium et magnésium soit les ions calcium seuls.
Au cours du dosage complexométrique de la dureté d'une eau,
on utilisera un indicateur coloré: le noir d'ériochromeT (NET) de couleur
lie-de-vin en présence des ions Ca2+ et Mg2+ et qui passe
à la couleur bleue lorsque les ions sont masqués après complexation.
II – But de la
manipulation.
Vous disposez d'une solution
titrante d'EDTA sensiblement 0,01 mol/L qu'il faut doser précisément au
cours d'une expérience préalable grâce à une solution étalon de carbonate de
calcium que vous devez fabriquer .
Une fois connue la concentration exacte de la solution
aqueuse d'EDTA, vous l'utiliserez pour déterminer la dureté des eaux proposées.
En France, la dureté d'une
eau s'exprime en degré hydrotimétrique français (DHF) :
un
DHF équivaut à 10 mg de carbonate de calcium par litre de solution aqueuse.
Pour effectuer le
calcul du DHF :
Les ions calcium et magnésium qui sont dosés simultanément
sont assimilés à des ions calcium (provenant arbitrairement de la dissolution
d'un carbonate de calcium de masse molaire 100 g.mol-1).La
concentration en Ca2+ est ensuite convertie en mol de CaCO3
par litre puis en mg/L et enfin en DHF.
III – Préparation de
la solution étalon et dosage de la solution d'EDTA .
On se fixe de préparer 100 mL
d'une solution aqueuse de carbonate de calcium de concentration telle que 10 ml
de cette solution nécessite une coulée de burette d'environ 10 mL de la
solution d'EDTA sensiblement centimolaire.
Calculer la masse de sel à peser.
Effectuer cette pesée dans un petit bécher propre et sec.
Dissoudre le sel dans le bécher en versant délicatement 10 à
15 mL d'eau désionisée puis quelques gouttes d'HCl concentré tout en agitant ;
et ceci jusqu'à dissolution complète du solide (Solution limpide).
Ecrire l’équation-bilan de la réaction correspondante.
Verser le liquide ainsi que les eaux de rinçage du bécher
dans une fiole de 100mL et compléter jusqu'au trait de jauge.
Agiter la fiole par retournement au moins 5 ou 6 fois.
Pipeter 10 ml de la solution étalon de CaCO3 et
les mettre dans un erlen de 250 mL.
Ajouter 5 mL de solution tampon pH = 10 (mesure du volume à
l'éprouvette) et quelques grains de l'indicateur coloré.
Mettre la solution d'EDTA dans la burette et effectuer le
dosage jusqu’à coloration persistante.
Ne pas jeter le contenu de l’erlenmeyer afin de garder pour
le dosage suivant ce témoin coloré
Ecrire les deux équations du dosage qui ont lieu
simultanément et déterminer les valeurs des constantes de réactions.
Ces réactions sont-elles totales ?
Les données
expérimentales sont : pKdissocation 1 = 10,7 et pKdissocation
2 = 8,6 . le complexe EDTA- calcium est plus stable que le complexe EDTA-
magnésium.
Calculer la concentration de la solution aqueuse d'EDTA.
IV – Détermination de
la dureté des eaux mises à votre disposition .
La stabilité des complexes formés entre l’E.D.T.A. et les
cations varie avec le pH.
Tout dépend en fait de la valeur de la constante de
formation du complexe.
Cette différence de comportement permet un dosage sélectif
en faisant varier les conditions d’acidité.
a- Détermination du
degré hydrotimétrique total d’une eau
(pH=10)
Demander
les échantillons d'eau à l'enseignant qui vous indiquera aussi les volumes à
utiliser dans chaque cas ainsi que les quantités de solution tampon.
Calculer la dureté (en DHF) de chacune des eaux proposées.
Comparer avec l’étiquette de la bouteille (données :MCa=
40 g/mol et MMg = 24 g/mol)
b- Détermination de
la teneur en calcium (pH=12 – 13)
Demander
les échantillons d'eau à l'enseignant qui vous indiquera aussi les volumes à
utiliser dans chaque cas.
Ajouter 5 mL de solution d’hydroxyde de sodium à 2 mol/L) et
quelques grains de l'indicateur coloré(calcon).
Agiter et doser par l’EDTA.
Quel est l’interêt de
travailler dans cette zone de pH (Ks(Mg(OH)2)=1O-10,8) ?
Quel est la solubilité de Mg2+ à pH=12 ?
En déduire la teneur en calcium et en magnésium des eaux
étudiées.
Indiquer vos résultats avant de partir. Et n'oubliez pas la
propreté.
2- ÉTUDE CINÉTIQUE DE LA
RÉACTION DE L' EAU
OXYGÉNÉE SUR LES IONS
IODURE
I – But de la
manipulation.
Établir
expérimentalement l'ordre partiel de la réaction relatif à l'eau oxygénée.
On rappelle le résultat déjà démontré : l'ordre vaut un si
le logarithme de la concentration est proportionnel au temps de réaction.
Refaire cette démonstration. La base du logarithme a-t-elle de l'importance?
Peut-on permettre à la température de varier pendant l'expérience?
II – Produits.
1)
Vous disposez d'une solution aqueuse d'eau oxygénée à
0,5 mol/L
2)
Préparer 50 mL d'une solution aqueuse de thiosulfate de
sodium 1 mol/L à partir du sel cristallisé de masse molaire 248 g.mol-1
. Quelle est la masse à peser? À dissoudre entièrement dans le bécher (environ
30 ml d'eau distillée) puis à verser dans la fiole de 50 mL en complétant avec
les eaux de rinçage du bécher. Remarquer la dissolution endothermique!
Cette solution sera versée dans
la burette.
3)
A votre disposition se trouve une solution aqueuse d'iodure de potassium KI
à 5%
ainsi qu'une solution d'acide
sulfurique 1 M. Attention danger!
et un flacon compte-gouttes
d'empois d'amidon.
III – Mode
opératoire.
Dans un erlen de 250 mL introduire, dans l'ordre indiqué, à
l'aide d'une éprouvette :
e
10 ml de KI à 5%
e
25 ml de H2SO4 à
1mol/L
e
125 ml d'eau distillée
e
10 gouttes d'empois d'amidon
Verser dans l'erlen 0,5 mL du thiosulfate qui se trouve dans
la burette
Déclencher le chronomètre lorsque vous introduisez dans
l'erlen les 10 mL d'eau oxygénée pipetée.
Noter le temps t1 au bout duquel apparaît la
coloration.
Rajouter aussitôt
0,5 ml de thiosulfate. Noter le temps t2 pour obtenir à nouveau la
coloration. Continuer ainsi jusqu'à 8 ml de thiosulfate.
IV – Réactions
simultanées.
 H2O2 + 2 I- + 2 H+ 2 H2O + I2
H2O2 + 2 I- + 2 H+ 2 H2O + I2
 I2 +
2 S2O32- 2
I- + S4O62-
I2 +
2 S2O32- 2
I- + S4O62-
La seconde réaction est quasi-instantanée par rapport à la
première.
V – Résultats.
Quels sont les réactifs en excés ?
Quelle technique ici est utilisée pour déterminer la valeur
de l’ordre partiel ?
Calculer les concentrations [ H2O2]0
au temps t0 = 0 ainsi que [H2O2]t
aux temps t1, t2, …Porter le logarithme du quotient de [H2O2]0
par [H2O2]t en fonction du temps t ; pour cela présenter les résultats des calculs
sous forme de tableau.
En déduire l'ordre partiel de la réaction relatif à H2O2.
Déterminer la valeur du temps de demi-réaction.
3 - MANGANIMÉTRIE
I – But de la
manipulation.
Doser des
solutions aqueuses réductrices en utilisant les propriétés oxydantes d'une
solution aqueuse de permanganate de potassium
KMnO4
en milieu acide :
MnO4- + 5 e- + 8 H+ D Mn2+
+ 4 H20
(violet) (incolore)
On déterminera au préalable, avec précision, la
concentration de la solution de permanganate fournie qui est approximativement
de 0,020 mol/L.
II – Dosage de la
solution de permanganate par des ions Ferreux ( Fe2+)
1 – Écrire
les deux demi-réactions ainsi que la réaction-bilan.
(les ions ferreux se transforment en ions ferrique Fe3+)
2 – Mettre
la solution de permanganate dans la burette.
3 –
Calculer la masse de sel de Mohr (Fe2+; 2 NH4+;
2 SO42-; 6 H20 : masse molaire 392 g.mol-1
)
nécessaire
pour que le dosage par la solution de permanganate sensiblement 0,02 mol/L se
produise pour
un volume d'environ 10 mL de solution de MnO4- .
Indiquer à
l'enseignant la valeur trouvée.
4 – Peser
la quantité de sel de Mohr calculée, ou une valeur voisine connue avec le
maximum de
précision
compatible avec la précision des autres grandeurs qui interviennent dans le
dosage.
Dissoudre ce sel dans de l'eau distillée.
5 – Ajouter
10 ml d' H2SO4 1 mol/L prélevés à l'éprouvette.
6 –
Effectuer le dosage jusqu'à coloration rose de la solution.
7 –
Calculer alors la concentration réelle de la solution de permanganate mise à
votre disposition.
8 –
Recommencer au moins une fois l'ensemble des opérations et vérifier que
vos deux résultats
sont cohérents
; sinon recommencer à nouveau jusqu'à satisfaction en éliminant les résultats
aberrants
après avoir justifié votre choix.
III – Détermination
de la concentration d'une eau oxygénée du commerce.
Dans le commerce de détail on
trouve des solutions aqueuses de 10 ; 20 ou 30 volumes ( 10 vol. ; 20 vol ; 30
vol.) les solutions plus concentrées étant réellement très dangereuses. Cette
façon d'exprimer la concentration en nombre de volumes n'est pas
"correcte" mais usuelle. Il suffit de savoir qu'une solution molaire
en eau oxygénée correspond à une concentration de 11,2 vol. Essayer de
justifier cette correspondance en
écrivant la réaction de décomposition spontanée de l'eau oxygénée en eau avec
dégagement de dioxygène.
1 – Prendre connaissance de la
solution commerciale pour laquelle vous devez vérifier la concentration. Vu cette
valeur il est claire que l'utilisation de votre solution de permanganate
nécessite de travailler sur une solution diluée d' H2O2
sinon il vous faudrait utiliser plusieurs dizaines de burettes de permanganate!
Écrire les deux demi-réactions qui correspondent à la réaction spontanée
de MnO4- sur H2O2 pour obtenir Mn2+
et O2 . Écrire l'équation bilan.
2 – Calculer le volume de la solution commerciale
qu'il faut pipeter afin de fabriquer 100 mL de solution diluée ; de sorte que
10 mL de cette solution diluée nécessitent une coulée de burette de 10 mL de
permanganate. Indiquer votre résultat à l'enseignant et si votre résultat est
bon, il vous confiera le flacon de la solution commerciale.
3 – Préparer correctement les 100
mL de la solution d'eau oxygénée diluée.
Bien agiter.
4 – Pipeter 10 ml de la solution
diluée et les doser par la solution aqueuse de permanganate dont la
concentration vous est connue
grâce à la précédente expérience.
Calculer la concentration réelle
(exprimée en volumes) de la solution commerciale.
Comparer à la valeur indiquée sur
l'étiquette et expliquer la différence.
5 – Recommencer l'expérience
toujours sur 10 mL de la solution diluée d' H2O2 .
Avant la fin de la séance, indiquer vos résultats à
l'enseignant qui note l'exécution du TP ainsi que la propreté du matériel que
vous venez d'utiliser.
4- DÉTERMINATION D'UN PRODUIT DE SOLUBILITÉ PAR POTENTIOMÉTRIE.
I – But de la
manipulation.
Dosage
argentimétrique d'une solution aqueuse d'iodure de potassium suivi par potentiométrie.
Détermination du produit de solubilité de l'iodure d'argent.
II – Expérience.
Vous
disposez d'une solution aqueuse de nitrate d'argent de concentration connue:
voir sur la bouteille. Attention! Même diluée la solution de AgNO3
est dangereuse pour l'épiderme : c'est tout de même ce que l'on utilise pour
brûler les verrues!
Mettre la solution de nitrate d'argent dans la burette.
Pipeter 10 ml de la solution d'iodure de potassium et placer
les dans un bécher de 250 mL en ajoutant environ 150 mL d'eau désionisée.
Mettre en place les deux électrodes. L'une est une électrode
de référence ( ECS ) utilisée avec un pont salin à nitrate d'ammonium afin que
des ions chlorure ne se retrouvent pas dans la solution étudiée. L'autre
électrode est une électrode indicatrice d'argent qui se comporte comme une
électrode de seconde espèce dès la première goutte d'argent versée.
Effectuer
une première expérience rapide en versant des fractions de 1 ml de solution
d'argent. Cela vous permet de connaître la valeur approchée du volume de
solution nécessaire pour obtenir une variation brusque de la force
électromotrice de la pile .
Recommencer
l'expérience en utilisant au mieux des volumes de solution ajoutée compatibles
avec les renseignements précédemment obtenus. Dans chaque cas, on prendra soin
de verser un volume d'environ deux fois le volume équivalent.
III – Dépouillement.
Ecrire la
réaction chimique
Tracer la
courbe donnant la f.é.m. de la pile en fonction du volume de solution de AgNO3
versée et déterminer graphiquement les coordonnées du point équivalent. On
donne le potentiel de l'électrode ECS de référence : + 0,245 V ( par rapport au
0,000 V de l'électrode normale à hydrogène : ENH , à toute température ).
Ecrire
l'expression de la loi de Nernst pour l'électrode indicatrice en fonction de
[Ag+] sachant que E°(Ag+/Ag) = 0.8 V
A quel
point de la courbe correspond l'égalité des concentrations des ions Ag+
et I- libres en solution ?
En déduire la valeur du produit de solubilité de
l'halogénure d'argent considéré et la valeur de pKs
Déterminer la valeur de la constante de réaction du dosage.
Calculer la
valeur de la concentration de la solution de KI mise à votre disposition.
Les deux couples mis en jeu dans cette réaction sont :
Couple 1 :
Ag+/Ag avec E°(Ag+/Ag) = 0.8 V
Couple 2 : AgI/Ag avec pKs = ________
Déterminer la valeur du potentiel standard redox du couple
2.
Que pouvez-vous dire du pouvoir oxydant des ions argent lors
de la précipitation ?
Avant de partir, indiquer vos résultats, et n'oubliez pas de
faire votre vaisselle!
5 - DOSAGE REDOX
I – But de la manipulation.
On se propose de doser une
solution aqueuse de sulfate cérique
Ce(SO4)2 par une solution étalon de fer ferreux
: Fe II . Le dosage sera suivi par
potentiométrie en mesurant la différence de potentiel (assimilable à la force
électromotrice vue l'impédance d'entrée de l'appareil de mesure) entre deux
électrodes trempant dans la solution ; une électrode de référence des
potentiels dite E.C.S. et une électrode indicatrice de troisième espèce en
platine. Rappeler la constitution de l'électrode à calomel saturée en KCl ainsi
que son potentiel dans l'échelle des potentiels d'électrode dont le zéro est
l'électrode E.N.H.
II – Préparation de
la solution étalon réductrice.
Une solution étalon
d'ions ferreux Fe2+ se fabrique facilement à partir d'un sel
cristallisé hydraté d'ions Fe II : le sel de Mohr (sulfate double de fer et
d'ammonium cristallisant avec 6 molécules d'eau) de masse molaire 392 g/mol et
de formule chimique : FeSO4
, (NH4)2SO4 , 6H2O
On se propose de préparer 100 mL de
solution de sel de Mohr 0,05 mol/L .
Calculer la masse de sel à peser. Prélever par double pesée
dans un petit bécher propre et sec, la masse de sel de Mohr voulue et préparer
la solution dans une fiole jaugée.
III – Dosage
potentiométrique.
Par pipetage, prélever 10 ml de
la solution étalon d'ions Fe2+ et mettre cette solution dans un bécher de
250 mL .Y ajouter 10 mL d'acide sulfurique molaire (mesuré à l'éprouvette) et 1 grain d’indicateur
coloré (ortophénantroline).
Disposer les électrodes et faire le branchement électrique
avec le voltmètre. Choisir le calibre de mesure et faire le zéro de l'appareil.
Si nécessaire, ajouter de l'eau pour que les électrodes trempent correctement.
Mettre la solution de sulfate cérique dans la burette graduée.
Verser la
solution de sulfate cérique et à chaque ajout, noter la valeur de la d.d.p.et
la couleur de la solution.
IV – Influence de l’indicateur coloré d’oxydo-réduction
On réalise
cette fois-ci le dosage par les ions cérique d’un mélange d’ions ferreux et
d’ions ferreux complexés avec de l’orthophénantroline (couple oxydo-réducteur
dont la forme réduite et la forme oxydée ont des couleurs différentes).
Le mélange est réaliser à partir de 0,35 g
d’orthophénantroline (M = 198.23 g/mol)
et 0,7 g de sel de Mohr dans 50mL
[La solution à doser est déjà préparée sur la paillasse.]
Réaliser le dosage potentiomètrique de la solution de sel
cérique avec ___ mL de la nouvelle solution Demander le volume à l’enseignant
V – Dépouillement.
Tracer les
deux courbes donnant la d.d.p. en fonction du volume de solution cérique
ajoutée.
Écrire les
différentes réactions redox effectuées pour les deux dosages.
Calculer la
concentration de la solution aqueuse de sulfate cérique mise à votre
disposition.
Déterminer
les valeurs des potentiels normaux des couples (Fe II / Fe III) et (Ce III : Ce
IV)
On donne le potentiel
de l'électrode ECS de référence : + 0,245 V ( par rapport au 0,000 V de
l'électrode normale à hydrogène : ENH , à toute température ).
Comparer les deux dosages. Conclusion sur l’utilisation
d’un indicateur ?
6 -
DOSAGE PHMETRIQUE
I – But de la manipulation
Déterminer
les concentrations des diverses solutions d'acides proposées par une solution
de soude de concentration connue, le dosage étant suivi par pHmétrie à l'aide d'une électrode de verre
pour laquelle on mesure la différence de potentiel par rapport à une électrode
pratique de référence: l'électrode au calomel saturée en KCl.
II – Etalonnage du
pHmètre.
Le pH –
mètre enregistre la différence de potentiels entre l’électrode indicatrice (ou
électrode de mesure : ici électrode de verre) et l’électrode de référence
(argent- chlorure d’argent ou électrode au calomel saturé)
Vous disposez d'une solution étalon de pH = 4,0 . Placer les
électrodes dans cette solution et régler le pHmètre de telle sorte qu'il
indique la bonne valeur de pH. Rien ne prouve que l'électrode est linéaire sur
la zone de pH utilisée mais les dosages pHmétriques font appel à des variations
relatives de pH.
III – Manipulations.
Vous aurez
à doser successivement trois solutions aqueuses d'acides :
Une solution aqueuse d'un monoacide fort : HCl
Une solution aqueuse d'un monoacide faible : CH3COOH
Une solution aqueuse d'un polyacide : H3PO4
A chaque fois prélever 10 ml de la solution aqueuse d'acide,
ajouter assez d'eau pour que les électrodes trempent convenablement et verser
la soude tout en mesurant le pH de la solution ainsi obtenue.
Tracer la courbe de la variation du pH en fonction du volume
de soude ajouté.
Calculer la concentration de chacune des solutions aqueuses
d'acides proposées.
Rappeler la définition du pKA d’un acide.
Déterminer le pKa de l'acide acétique ainsi que les pKa
mesurables de l'acide phosphorique.
Déterminer pour tous les dosages, les valeurs des constantes
de réactions .(rappel : pKe=14)
IV – Questions.
Pourquoi
étalonne-t-on le pHmètre ?
La quantité
d'eau ajoutée pour que les électrodes trempent modifie-t-elle la forme de la
courbe et le point équivalent?
Peut-on par
pHmétrie différentier deux acides forts?
Pourquoi le
pH d'équivalence d'un acide faible est-il supérieur à 7 ?
La première
acidité de H3PO4 étant relativement forte pourquoi
n’obtient-on pas pH = pKa1= 2,1 à la première demi-équivalence
Pourquoi ne
distingue-t-on pas le troisième saut de pH dans le dosage de l’acide
phosphorique ? Répondre après avoir déterminer la valeur de la constante
de cette réaction sachant que pKa3(acide phosphorique) = 12,4 et pKe=14
V - les indicateurs colorés.
Un indicateur coloré HIn est constiué par un couple
acide-base faible dont la forme acide et basique ont des couleurs différentes.
teinte de HIn zone de virage teinte de In-
pKA-1 teinte sensible pKA+1 pH
Lors d’un dosage, si le saut de pH lors de l’équivalence est
assez étendu, on peut utiliser un indicateur coloré. Celui-ci doit posséder une
zone de virage dans le saut de pH.
L'indicateur coloré ne doit pas perturber le pH de la
solution dans laquelle il est dissous : on n'utilise que quelques gouttes d'une
solution diluée (souvent à 10-3 mol/L)
|
nom
|
|
zone
de virage
acide /
base
|
|
|
Violet
de méthyle
|
jaune
|
0.1
/ 1.5
|
bleu
|
|
Thymol
bleu ou bleu de thymol (Ier virage)
|
rouge
|
1,2
/ 2,8
|
jaune
|
|
Bleu
de bromophénol
|
jaune
|
3.0
/ 4.6
|
violet
|
|
Jaune
de méthyle
|
rouge
|
2,9
/ 4,0
|
jaune
|
|
Hélianthine
,Méthylorange
|
rouge
-rose
|
3,1
/ 4,4
|
orangé
|
|
Vert
de bromocrésol
|
jaune
|
3,8
/ 5,4
|
bleu
|
|
Méthylrouge
ou rouge de méthyle
|
rouge
|
4,2
/ 6,3
|
jaune
|
|
Bleu
de bromothymol
|
jaune
|
6,0
/ 7,6
|
bleu
|
|
Rouge
de phénol
|
jaune
|
6,8
/ 8,4
|
rouge
|
|
Rouge
de crésol
|
jaune
|
7,3
/ 8,8
|
rouge
|
|
Thymol
bleu ou bleu de thymol (2ème virage)
|
jaune
|
8,0
/ 9,6
|
bleu
|
|
Phénolphtaléine
|


![]()