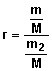Extraction d'un arôme : La menthone
I ) L'arôme naturel

1-a) Le nom de
cette technique est l’hydrodistillation, ou entraînement à la vapeur.
1-b) 1 :
chauffe ballon ; 2 : ballon à fond rond ; 3 : condenseur à
eau ; 4 : éprouvette graduée
 2-a) A : front de l’éluant ;
B : ligne de dépôt des espèces
chimiques
2-a) A : front de l’éluant ;
B : ligne de dépôt des espèces
chimiques
2-b) L’huile
essentielle contient les espèces chimiques suivantes :
menthone ;
menthol ; eucalyptol ; menthofurane ;
En effet les
rapports frontaux des différentes taches de l’huile essentielle sont égaux à
ceux des espèces chimiques menthone , menthol, eucalyptol, menthofurane.
De plus le
chromatogramme de l’huile essentielle
contient deux autres taches non identifiables. L’huile essentielle est
constituée de deux autres substances inconnues.
2-c)
![]()
II ) Arôme artificiel :
La menthone ne
représente que 10% de l'huile essentielle mais on peut préparer cet arôme par
oxydation ménagée du menthol, lui même obtenu par extraction de l'espèce
végétale (50% de l'huile essentielle)
|
|
Menthol |
menthone |
|
formule brute |
C9H18CHOH |
C9H18CO |
|
formule |
|
|
|
couleur |
Blanc |
incolore |
|
masse molaire(g.mol-1) |
156 |
154 |
|
température ébullition |
215°C |
209°C |
|
température de fusion |
43°C |
- 6,5°C |
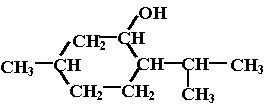
II-1 Le menthole
est un alcool secondaire car le carbone fonctionnel est lié à deux autres atomes
de carbone. Sa température de fsion est égale à 43°C, donc à 20°C il se trouve
sous forme solide
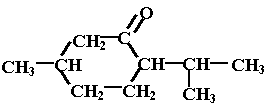
II-2) Le
groupement fonctionnel porté par la menthone est une cétone
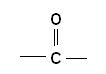
Sa température de
fusion est de –6,5°C et sa température d’ébullition des de 209°Cdonc à 20°C
elle se trouve sous forme liquide
3-a) L’intérèt du montage à reflux est de ne pas
perdre de produits et de réactifs car ceux-ci sont condenser au contact du
condenseur. En élevant la température la réaction est accélérer.
3-b Y a-t-il un
réactif en excès ? Si oui, lequel ?
Quelle masse théorique maximum m2 de menthone peut-on obtenir
?
ni(emnthol)= m1/M(menthol) = 15,6/156 = 0,1 mol
ni(MnO4-)
= C.V = 10-1 x 0,8 = 8 x 10-2 mol
![]()
Le menthol est en
défaut, le permanganate en excès.
La masse m2
de menthone théorique est :
m2 = 5.xmax
. M(menthone) = 5 x 0,02 x 154 = 15,4 g
3-c L’oxydation
se déroule à cette température car la menthone se trouve alors sous forme
liquide (T(fusion) = 42°C).
4) La densité du
cyclohexane est d = 0,78, seul la menthone est soluble dans ce solvant. La
solution aqueuse contenant les autres produits est plus dense (d = 1 environ). La phase qui surnage est
celle correspondant a la phase de plus faible densité. Il s’agit par conséquent
du solvant cyclohexane et de la menthone.
5) La séparation de
la menthone du cyclohexane se fait par distillation.
On obtient une masse
m' = 11,2 g de menthone.
5-a) La température d’ébullition du cyclohexane
est de 81°C, celle de la menthone est
de 209°C. Les 2 températures d’ébullition étant très différente on obtiendra
une bonne séparation des 2 produits .
5-b Rendement de
cette préparation.
r = n(obtenu
expérimentalement) / n(obtenu si la réaction est totale)
![]()