Chapitre 6 : créer et produire
des espèces
Synthèse d'un ester (bac Liban 2001) corrigé
préparation d'un
ester : éthanoate de benzyle présent
dans un extrait de jasmin
|
nom |
formule |
température ébullition sous
1 bar |
densité |
masse molaire (g/mol) |
|
alcool benzylique |
C6H5CH2OH |
205 |
d1 = 1,05 |
M1 = 108 |
|
acide éthanoïque |
CH3COOH |
118 |
d2 =1,05 |
M2 = 60 |
|
éthanoate de benzyle |
CH3COOCH2C6H5 |
214 |
|
|
|
Eau |
H2O |
100 |
1 |
18 |
masse volumique de
l’eau : a = 1g.mL-1
La réaction entre l'acide
éthanoïque et l'alcool benzylique permet d’obtenir l’ éthanoate de benzyle.
L'acide sulfurique joue le
rôle de catalyseur. On dispose d'une solution saturée de chlorure de sodium. On
chauffe à reflux.
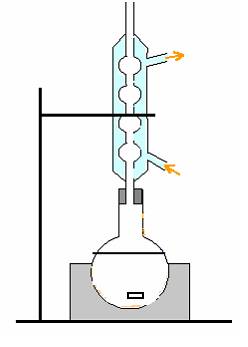
1)
Indiquer la
légende sur le montage à reflux.
2)
Rappeler la
formule générale des alcools, des acides carboxyliques et des esters.
3)
Ecrire l’équation
bilan en ne faisant apparaître que les formules semi développées des espèces
chimiques.
4)
Les réactifs et
le catalyseur sont miscibles avec l'eau : par contre l'éthanoate de benzyle est
peu miscibles à l’eau et insoluble dans l’eau salée. Proposer un protocole
opératoire en donnant son nom pour séparer à froid l'ester du milieu
réactionnel. Faire un schéma de l'appareil utilisé.
5)
En réalisant cette
synthèse à partir de V1 = 133,7 mL d'alcool et V2 = 74,3 mL d'acide, on obtient
m = 113,1 g d'ester. Le mélange est-il stoechiométrique ?
6)
Calculer le
rendement ‘r’ de la réaction.
7)
Quelle technique
utiliser pour vérifier si le produit obtenu est pur ? Faire un schéma en
expliquant la méthode utilisée.