Extraction d'un arôme : La menthone
I ) L'arôme
naturel :
La menthone est un des
constituants de certaines espèces de menthe dont la menthe poivrée «
Mentha piperita ». Son odeur et sa saveur fraîche, analogues à celles de
la menthe, en font un arôme très utilisé dans les produits alimentaires.
1) L'extraction de l'huile
essentielle de la menthe poivrée se fait en utilisant le dispositif
expérimental de la figure ci- après :

a) Donner le nom de cette
technique.
b) Nommer les différents
éléments numérotés qui constituent ce montage.
2) Pour vérifier la présence
de menthone dans l'huile essentielle extraite, on réalise une chromatographie
sue couche mince. L'éluant est un mélange constitué de 75% de chloroforme et de
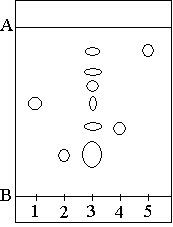
25% de cyclohexane. Le chromatogramme est donné ci-dessous :
|
Légende des dépôts : 1 : dépôt de menthone 2 : dépôt de menthol 3 : dépôt d’huile
essentielle de menthe poivrée 4 : dépôt d’eucalyptol 5 : dépôt de menthofuranne |
|
a) Que matérialisent les deux
traits situés en haut et en bas du chromatogramme et repérés par les lettres A
et B ?
b) En interprétant ce chromatogramme, nommer les substances contenues dans
l'huile essentielle étudiée.
c) Calculer pour l'éluant et le support utilisé le rapport frontal Rf
de la menthone.
II ) Arôme
artificiel :
La menthone ne représente que
10% de l'huile essentielle mais on peut préparer cet arôme par oxydation
ménagée du menthol, lui même obtenu par extraction de l'espèce végétale (50% de
l'huile essentielle)
|
|
menthol |
menthone |
|
formule brute |
C9H18CHOH |
C9H18CO |
|
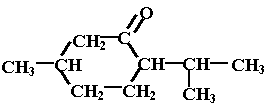
formule |
|
|
|
couleur |
blanc |
incolore |
|
masse molaire(g.mol-1) |
156 |
154 |
|
température ébullition |
215°C |
209°C |
|
température de fusion |
43°C |
- 6,5°C |
1) A quelle classe d'alcool
peut-on rattacher le menthol ?
Sous quel état physique se
présente-t-il à 20°C ?
2) Quel est le groupement
fonctionnel porté par la menthone ? Sous quel état physique se présente-t-il à
20°C ?
3) L'oxydation du menthol est
réalisée en milieu acide par l'ion permanganate MnO4- qui
appartient au couple oxydo-réducteur MnO4- / Mn2+.
Cette oxydation se traduit
par l'équation suivant :
2MnO4- + 5C9H18CHOH + 6H3O+
= 2Mn2+ + 5C9H18CO + 14H2O
On se propose de traiter une masse m1 = 15,6 g de menthol. On
utilise un volume V= 100 mL de solution oxydante de concentration C = 0,8 mol.L-1 acidifiée par quelques millitres d'acide
sulfurique concentré. Le dispositif expérimental utilisé est celui du chauffage
à reflux.
a) Quel est l'intérêt du
chauffage à reflux ?
b) Y a-t-il un réactif en excès ? Si oui, lequel ?
Quelle masse théorique maximum m2
de menthone peut-on obtenir ?
c) L'oxydation se déroule à une température voisine de 55°C.
Justifier la nécessité d'atteindre
cette température.
4) Le cyclohexane est un
solvant organique de densité d = 0,78 par rapport à l'eau et de température
d'ébullition 81°C. Parmi les espèces chimiques présentes dans le ballon, seule
la menthone est soluble dans le cyclohexane. On transvase le contenu du ballon
dans une ampoule à décanter et on y ajoute du cyclohexane. On agite puis on
laisse reposer. On observe la séparation de 2 phases. Dans l'ampoule à décanter
quelle est la phase surnageante ? Justifier.
5) La séparation de la menthone
du cyclohexane se fait par distillation.
On obtient une masse m' =
11,2 g de menthone.
a) Le procédé de séparation vous paraît-il judicieux ?
b) Calculer le rendement de cette préparation.