|
Compétences exigibles au bac
L'atome et la mécanique de Newton: ouverture
au monde quantique
Connaître les
expressions de la force d'interaction gravitationnelle et de la force
d'interaction électrostatique.
Savoir que l'énergie de l'atome est quantifiée et que la mécanique de Newton
ne permet pas d'interpréter cette quantification.
Connaître et exploiter la relation  , connaître la signification de chaque
terme et leur unité. , connaître la signification de chaque
terme et leur unité.
Convertir les joules en eV et réciproquement.
Interpréter un spectre de raies
Dans les échanges d'énergie, associer le MeV au noyau et l'eV au cortège
électronique
Energie d'un photon La lumière est constituée de corpuscules appelés photons. A
chaque photon correspond une onde électromagnétique de longueur d'onde ' l', de fréquence 'u ' et de célérité 'c' dans le vide (c=300 000 km.s-1). Un photon a une masse nulle et une énergie E,
produit de la constante de Planck 'h' par sa fréquence 'u '.
Dans le cas ou le photon se déplace
dans le vide son énergie est :
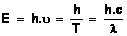
avec h = 6,62.10-34 J.s, T période de l'onde électromagnétique(s); 'u ' fréquence (Hz) ; 'c' célérité (m.s-1).
1 eV = 1,6x10-19
J
Niveaux d'énergies quantifiées
d'un atome : postulat de Bohr Afin
d'interpréter le spectre d'émission de l'atome d'hydrogène, en 1913 M. Bohr
énonce les postulats suivants :
-L'atome
possède différents niveaux d'énergie bien définis, E1, E2, E3 etc. Il
s'agit de valeurs discontinues (ou discrètes),
et non de valeur continues.
-
Les variations d'énergie DE de l'atome sont quantifiées.
- Quand l'atome passe d'un état d'énergie 'Ep' élevé à un niveau d'énergie 'En' plus faible il
libère une énergie égale à Ep - En.
- Le niveau de plus basse énergie de l'atome est
appelée le niveau fondamental. Lorsqu'un atome
se trouve à un niveau d'énergie supérieur au niveau fondamental, on dit qu'il
est excité.
Emission d'un photon au cours de la
désexcitation
Lorsqu'un atome se désexcite en effectuant une transition électronique
d'un niveau d'énergie Ep à un niveau d'énergie plus
faible 'En', il émet un photon d'énergie :

Ep et En en joule (J), h constante de Planck,
h = 6,62.10-34J.s , u fréquence(Hz) de l'onde électromagnétique associé
au photon, c (m.s-1 )
célérité du photon.
Interprétation
énergétique des spectres atomiques
Un gaz excité sous basse pression émet, en se désexcitant, des rayonnements visibles (ou
des rayonnements ultraviolets) possédant chacun une longueur d'onde. La
valeur de l est
déterminée par le passage d'un niveau d'énergie Ep
supérieur à un niveau de plus basse énergie En : émet, en se désexcitant, des rayonnements visibles (ou
des rayonnements ultraviolets) possédant chacun une longueur d'onde. La
valeur de l est
déterminée par le passage d'un niveau d'énergie Ep
supérieur à un niveau de plus basse énergie En :
|
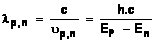
L'ensemble des rayonnements lumineux de
longueur d'onde ln,p va produire le spectre de raies d'émission du
gaz.
Niveaux d'énergie électroniques
d'un atome
Un atome peut acquérir différents niveaux
d'énergie électronique qui proviennent de :
* l'interaction des électrons entre eux et
des électrons avec le noyau.
* l'énergie cinétique des électrons.
Lorsqu'un atome perd une partie de cette
énergie en passant d'un niveau 'p' à un niveau 'n' il émet des rayonnements
d'énergie de l'ordre de l'électron volt. Ces
rayonnements se situent généralement dans le domaine du visible (400 nm < l < 800 nm) ou dans l'ultraviolet 10-10 m
< l <
0,4.10-6 m
Niveaux d'énergie d'un noyau Le noyau possède des niveaux d'énergie nucléaire
du fait de l'interaction des nucléons. Les énergies correspondantes sont
de l’ordre du MeV.
Lors d'une désintégration radioactive le
noyau fils Y est, en général, dans un état excité ( noté Y* ). En se désexcitant, il émet un rayonnement g de forte énergie. La longueur d'onde l du rayonnement est de l'ordre du picomètre
Niveaux d'énergie d'une molécule
On distingue quatre types d'énergie au sein
d'une molécule :
Ee, énergie électronique des électrons.
Comme pour les rayonnements électroniques
des atomes, les rayonnements émis se trouvent dans le domaine du visible et
des UV.
Et , énergie de translation de la
molécule
Ev , l'énergie de vibration due aux oscillations des noyaux autour de leur
position d'équilibre.
La transition entre deux niveaux d'énergie
de vibrations correspond à :
DE(vibration) = 0,1 eV
Les longueurs d'onde correspondant à ce type
de transition sont dans le domaine de l'infrarouge.
Er ,l'énergie de la molécule autour de son centre d'inertie.
La transition entre deux niveaux d'énergie
de rotation est de l'ordre du milli électronvolt.
Les longueurs d'ondes correspondantes, font
partie de l'infrarouge lointain.
|