1) Les alcools
un alcool est caractérisé par un groupement hydroxyle -OH, lié à un carbone tétragonal( carbone lié à 4 autres atomes)
Le groupe
hydroxyle -OH est appelé le
groupe caractéristique ou groupe fonctionnel des alcools.
la formule brute générale
des alcools saturés (liaison covalente simple entre les atomes de
carbone et d'hydrogène) est:
Cn H2n+1 -OH
Les 3 classes d'alcool
* un alcool est primaire si le carbone fonctionnel est lié à 1, ou 0 atome de carbone
formule générale: R-CH2-OH ou (CH2-OH)
*un alcool
est secondaire si le carbone fonctionnel est lié à
2 atomes de carbone.
*un alcool
est tertiaire si le carbone fonctionnel est lié à
3 atomes de carbone.
2) acides carboxyliques
R-COOH
définition
un acide carboxylique présente
le groupe caractéristique fonctionnel carboxyle.
La formule générale
des acides carboxyliques est :
Le carbone fonctionnel est trigonal
(lié à 3 autres atomes).
nomenclature
Le nom du composé est précédé du mot acide. On remplace ensuite le "e" du nom de l'alcane correspondant par la terminaison "oïque".
3) Anhydride d'acide
Le groupe fonctionnel anhydride
d'acide est :
les anhydrides d'acide ont pour
formule semi-développée:
Ils proviennent d'une réaction de condensation entre 2 molécules d'acide , avec élimination d'une molécule d'eau.
nomenclature
Le nom de l'anhydride d'acide s'obtient
en remplaçant le mot acide par le mot anhydride.
exemple: l'anhydride
éthanoïque , anhydride éthanoique-propanoïque:
Les anhydrides d'acide liquide ou solide à température ordinaire sont irritants pour les yeux et la peau et doivent être manipulés avec précaution.
II) Les esters
1) Définition
Un ester est un composé organique
qui possède le groupe caractéristique :
Remarque : parfois on n'écrit pas le carbone
dans la formule du groupe caractéristique
La formule générale
des esters s'écrit :
Avec R = H ou R = chaine carbonée et
R' = chaine carbonée.
2) Nomenclature
La première partie désigne
la chaîne carbonée contenant le carbone fonctionnel: on remplace
la terminaison oîque par "oate". La seconde partie désigne
la chaîne liée à l'atome d'oxygène: elle est
nommée comme un radical alkyle.
exemple: propanoate d'éthyle
III) Equilibre d'estérification hydrolyse
1) Caractéristiques de la réaction d'estérification
On réalise un mélange d'acide carboxylique et d'alcool. La réaction produit un ester et de l'eau suivant l'équation bilan suivante :
R-CO2H+R'-OH = R-CO2-R'+H2O
La réaction d'estérification
est lente, limitée, athermique.
Le taux d'avancement final tf
est
inférieur à 1.
La réaction inverse de la
réaction d'estérification est appelée réaction
d'hydrolyse.
À partir d'un ester et de
l'eau on produit un acide carboxylique et un alcool. Son équation
bilan est :
R-CO2-R'+H2O = R-CO2H+R'-OH
L' hydrolyse d'un ester est une réaction lente, limitée, athermique. Son taux d'avancement final est inférieur à un.
3) L'équilibre d'estérification hydrolyse
La réaction d'estérification
est la réaction inverse de l'hydrolyse de l'ester. Ces deux réactions
se limitent l'une l'autre.
L'état d'équilibre
est atteint lorsque la vitesse de formation de l'ester est égale
à sa vitesse de disparition par la réaction d'hydrolyse.
La constante d'équilibre K de la réaction d'estérification est :
![]()
la constante d'équilibre K' de la réaction d'hydrolyse de l'ester est l'inverse de celle de l'estérification :
![]()
IV) Facteurs permettant d'atteindre plus rapidement l'état d'équilibre
1) influence de la température
L'augmentation de température
augmente la vitesse de la réaction d'estérification ou d'hydrolyse,
mais ne modifie pas leur rendement( car la réaction est athermique).
L'augmentation
de température permet d'atteindre plus rapidement l'état
d'équilibre.
2) influence d'un catalyseur
Un catalyseur
permet d'atteindre plus rapidement l'état d'équilibre de
la réaction d'estérication ou d'hydrolyse.
mais modifie pas le rendement
de la réaction.
V) Amélioration du rendement d'une estérification
1) rendement d'une réaction
Soit la réaction suivante
: a.A + b.B = c.C
Si le réactif A est en excès
Le rendement 'r' de la réaction est :
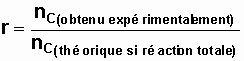
Si la réaction est totale, le nombre de mole théorique de produit formé C est relié au nombre de mole initial de réactif en défaut A par la relation :
![]()
Par conséquent le rendement
de la réaction est donné par la relation :

2) utilisation d'un réactif en excès
En augmentant l'excès d'un des réactifs (acide ou alcool) de la réaction d'estérification, on augmente son rendement, et son taux d'avancement final.
3) élimination d'un produit formé
Une fois l'équilibre d'estérification atteint, en éliminant l'ester ou l'eau formé(e), le quotient de réaction devient inférieur à la constante d'équilibre K.
Le système évolue à nouveau dans le sens direct de la réaction d'estérification. Le rendement est amélioré car le nombre de mole de réactif en défaut diminue.
Pour éliminer
l'ester on peut l'utiliser un montage de distillation
fractionnée.
Pour éliminer
l'eau on peut utiliser l'appareil de Dean et Stark, ou utiliser
un déshydratant tel que l'acide sulfurique concentré( H2SO4).
4) Influence des réactifs
Le rendement de la réaction d'estérification ne dépend pratiquement pas de la nature de l'acide carboxylique utilisé. Par contre il dépend de la classe d'alcool utilisée. (67 % pour un alcool primaire, 60 % pour un alcool secondaire, 5 % pour un alcool tertiaire.
La constante d'équilibre K d'une réaction d'estérification dépend de l'alcool utilisé.