A) La transformation d'un système chimique est-elle toujours
rapide ?
Chapitre 1 : transformations chimiques lentes ou rapides ?
I) Les
réactions d'oxydoréduction
1) Couple oxydant réducteur
Un oxydant est une espèce chimique qui peut gagner un ou plusieurs électrons.
Un réducteur peut
perdre un ou plusieurs électrons. Un couple d'oxydoréduction Ox/Red est
constitué par un oxydant et son réducteur conjugué. Ils sont liés par une
demi-réaction d'oxydoréduction :
Ox + n.e- = Red
Une réaction d'oxydoréduction met
en jeu deux couples d'oxydoréduction :
Ox1/Red1 et Ox2/Red2.
La réaction d'oxydoréduction peut s'écrire :
a.Ox1 + b.Red2 = c.Red1 + d.Ox2
exemple :
Cu2+ + 2e- = Cu ½ équation de réduction car gain
d’électron(RG)
Zn = Zn2+ + 2e- ½ équation d’oxydation : perte
d’électrons
Cu2+ + Zn = Zn2+ +
Cu réaction d’oxydoréduction
2) équilibrer une équation redox
Vidéo :
équilibrer une équation redox
Exemple sur
la réaction entre les couples Cr2O72-/Cr3+ et + C2H4O2/
C2H6O (acide éthanoïque / éthanol)
* Conservation
du nombre d'atomes de l'élément oxydé ou réduit
Cr2O72-
= 2 Cr3+
*
Conservation du nombre d'atomes de l'élément oxygène par apport de molécules
d'eau :
Cr2O72-
= 2 Cr3+ + 7 H2O
*
Conservation du nombre d'atomes d'hydrogène par apport d'ions H+
(car la réaction a lieu en milieu acide)
Cr2O
72- + 14 H+ = 2 Cr3++ 7 H2O
*
Conservation des charges électriques par apport d'électrons :
Cr2O7
2- + 14 H+ + 6 e - = 2 Cr3++ 7 H2
O
De la même
manière la demi-réaction d'oxydation de l'éthanol est :
C2H6O + H 2O = C2H4O2
+ 4 H+ + 4 e-
On multiplie
la demi-équation d'oxydation par le nombre d'électrons intervenant dans la
demi-équation de réduction
(x 6) et
inversement. On fait la somme des 2 demi-équations pour obtenir l'équation
bilan.
4 x (Cr2O7 2-+ 14 H+ + 6 e
- = 2 Cr3++ 7 H2O ) +
6 x (C2H6O + H2O = C2H 4O2
+ 4 H+ + 4 e-)
=
4 Cr2O72- + 56 H+ + 24 e-
+ 6 C2H6O + 6 H2O = 6 C2H4O2
+ 24 H+ + 24 e- + 8 Cr3+ + 28 H2O
On simplifie
l'équation bilan :
4 Cr2O7
2-+ 32 H+ + 6 C 2H6O = 6 C2H4O2
+ 22 H 2O + 8 Cr3+ ou en divisant chaque terme par 2 :
2 Cr2O7 2-+ 16 H+ + 3 C
2H6O = 3 C2H4O2 + 11 H 2O
+ 4 Cr3+
II) Dosage d'oxydoréduction
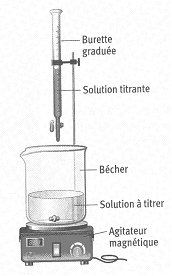 Animation :
matériel nécessaire pour effectuer un dosage pHmétrique
Animation :
matériel nécessaire pour effectuer un dosage pHmétrique
Un dosage permet de déterminer la concentration molaire
d'une espèce chimique en solution. L'espèce dosée est appelée le réactif titré. Elle est dosée par un réactif titrant. À
l'équivalence, le réactif titré et l'espèce chimique titrante sont
introduits dans les proportions stœchiométriques.
Une réaction est dite instantanée lorsque
l'évolution du système se fait en une durée inférieure à celle de la
persistance rétinienne (environ 0,1 seconde). Une réaction est dite lente si elle dure de
quelques secondes à quelques années.
III) Facteurs cinétiques
L'évolution d'un système chimique est d'autant
plus rapide que :
-
que les concentrations
en réactifs sont grandes
-
que la
température est élevée
-
qu’il ya apport
d’un catalyseur
Chapitre 2 : suivi temporel d'une réaction chimique
I) Suivi
temporel d'une réaction par
1) Protocole expérimental
Pour déterminer par un dosage la concentration
d'une espèce au cours du temps :
1) On effectue le mélange des réactifs.
2) A intervalles de temps réguliers, on
prélève une partie du mélange que l'on refroidit brutalement pour arrêter la
réaction (cette méthode est appelée la trempe).
3) On dose une espèce de l'échantillon
(réactif ou produit) avec une autre espèce chimique.
2) Composition du système à
l'instant 't'
Le dosage permet de déterminer directement ou
indirectement l'avancement x(t) au cours du temps.
On détermine alors à l’aide d’un tableau
d’avancement la quantité de matière des réactifs et produits à chaque instant
't'.
exemple :
|
État du système |
Avancement
(mol) |
H–CO2–CH2–CH3
+HO– = HCO2– + CH3–CH2–OH |
|||
|
État initial |
0 |
n0 |
n0 |
0 |
0 |
|
État intermédiaire |
x(t) |
n0 – x(t) |
n0 – x(t) |
x(t) |
x(t) |
|
Etat final |
xmax |
no-xmax |
no-xmax |
xmax |
xmax |
II) Suivi temporel des
concentrations par méthodes physiques
A partir de la conductance ou de
l'absorbance, on détermine les concentrations des espèces chimiques au cours du
temps. On en déduit l'avancement.
1) La conductimétrie
Animation :
exemple de déplacement d’ions Na+ et Cl- dans une
solution.
Animation :
effectuer un dosage conductimétrique
La conductance au cours du temps G(t) d'une
solution, comprise entre deux plaques d'un conductimètre est :
![]()
L: distance entre les plaques (m)
s(t) : conductivité de la solution à l'instant t (S.m-1)
k: constante de la cellule(m)
La
conductivité s d'une solution contenant des ions de concentration [A]
et [B] est :
![]()
s : conductivité en S.m-1
l: conductivité molaire de l'ion correspondant
(S.m2.mol-1)
[X]: concentration molaire en mol.m-3
exemple :
|
État du système |
Avancement
(mol) |
H–CO2–CH2–CH3 + HO– =
HCO2– + CH3–CH2–OH |
|||
|
État initial |
0 |
C0 |
Co |
0 |
0 |
|
État intermédiaire |
x(t) |
C0 – x(t)/V |
C0 – x(t)/V |
x(t)/V |
x(t)/V |
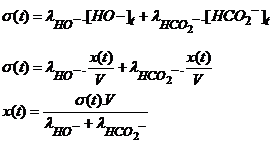
2) La spectrophotométrie
a) Absorbance
Une radiation lumineuse monochromatique de
longueur d'onde l traverse une cuve
contenant une solution colorée par une espèce chimique. Une partie du
rayonnement est absorbée. l'absorbance pour cette longueur d'onde est notée A(l). A est une grandeur
sans dimension. L'absorbance est une grandeur additive.
b) Loi de Beer Lambert
L'absorbance d'une solution colorée est donnée
par la relation :
![]()
e (![]() ): coefficient d'absorption molaire qui dépend
de la nature de l'espèce dissoute, de la température, et de la longueur d'onde
(m-1 .mol-1 .L)
): coefficient d'absorption molaire qui dépend
de la nature de l'espèce dissoute, de la température, et de la longueur d'onde
(m-1 .mol-1 .L)
L: longueur de solution traversée (m)
C(mol.L-1): concentration de
la solution
exemple :
|
|
2I– (aq) + S2O82–(aq) =
I2 (aq) + 2 SO42– aq) |
||||
|
État
initial |
c1 |
0 |
0 |
||
|
Au
cours de la transformation |
x |
C1
- .x(t)/V |
C2
– x(t)/V |
x(t)/V |
2x(t)/V |
|
État
final attendu |
xmax |
C1
-.xmax/V |
C2
– xMAX/V |
xMAX/V |
2xMAX/V |
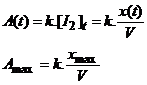
Chapitre 3 : vitesse de réaction chimique
I) Vitesse
volumique d'une réaction
1) Définition vidéo
La vitesse volumique 'v(t)' d'une réaction calculée
à l'instant 't' est égale à la dérivée de l'avancement 'x' par rapport au
temps, divisée par le volume de solution V :
![]()
Unité légale : mol.s-1m-3
Animation
exemple
1 d’évolution de vitesse de réaction
exemple
2 : d’évolution de vitesse de réaction
exemple 3 :
vitesse de réaction entre les ions iodure et peroxodisulfate
2)
Détermination graphique de la vitesse volumique
1) Tracer la courbe de  l'avancement en fonction du temps x = f(t)
l'avancement en fonction du temps x = f(t)
2) Déterminer
graphiquement la dérivée de l'avancement par rapport au temps à l'instant t1
(dx/dt)t1.
(dx/dt)t1
représente la pente de la tangente au point M1(t1,x1).
Pour déterminer (dx/dt)t1:
a) Tracer la tangente à la courbe au point M1
b) Prendre 2 points Mo et M2 très éloignés
(pour plus de précision)
Mo
(to = 1 s ; xo = 1 mol) M2(t2
= 3s ; x2 = 4 mol)
c) Calculer la dérivée de l'avancement par
rapport
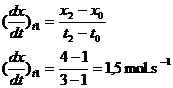
3) Diviser la valeur
obtenue par le volume de solution V pour obtenir la vitesse volumique à
l'instant t1 :
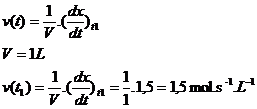
Dans cet exemple à
l’instant t1 par litre de solution, l’avancement x augmente de 1,5
mol par seconde.
3) Temps de
demi-réaction t1/2 vidéo
Animation :
temps de demi réaction
Le temps de demi-réaction est la durée au bout de
laquelle l'avancement est égal à l'avancement final divisée par 2 :
![]()
Dans le cas où la réaction
est totale, xf = xmax . Par conséquent le temps
de demi-réaction est la durée au bout de laquelle l'avancement est égal à la
moitié de l'avancement maximal :
![]()
II) Interprétation
microscopique de l'influence de la concentration sur la vitesse
1) Réaction en
solution ou en phase gazeuse
Animation : Vitesse de réaction
entre les ions iodure et peroxodisulfate
En phase gazeuse ou en
solution, la vitesse de réaction augmente, quand la concentration en réactif et
la température augmente.
2) Mélange
hétérogène : solide liquide Vidéo
La réaction entre un
solide et un liquide est d'autant plus rapide que la surface de contact entre
les deux est importante.
3) Chocs
efficaces
Pour que les chocs entre
deux espèces chimiques puissent être efficaces il faut :
® Une bonne disposition géométrique.
® Une énergie cinétique suffisante pour casser les
liaisons.
® Le choc doit se faire entre deux réactifs.
Exemple : A+B = C
Le choc doit se faire entre A et B avec une énergie
suffisante et que les 2 molécules soient disposées correctement.