B) La transformation chimique est-elle toujours totale?
4
: équilibre chimique, quotient de réaction Qr et
constante d'équilibre K
6
: réaction acidobasique, titrage
Chapitre 4 :
équilibre chimique, quotient de réaction Qr et
constante d'équilibre K
I) Réaction
acido-basique
À chaque acide correspond une base conjuguée,
le tout formant un couple acide / base.
exemple : HNO3(aq)
= NO3-(aq) + H+(aq)
couple acide base : HNO3(aq) / NO3-(aq)
Une espèce pouvant être à la fois une base est
un acide est une espèce amphotère (ou ampholyte).
exemple : l’eau est une
espèce amphotère :
H2O(aq) / HO-(aq) ; H3O+(aq) / H2O(aq)
H2O(aq) = HO-(aq) + H+(aq)
H3O+(aq)
= H2O(aq) + H+(aq)
2) Réaction acido-basique
Une réaction acido-basique a lieu entre deux
couples acide/base A1/B1 et A2/B2. L'acide du couple 1 réagit avec la base du
couple 2 pour donner la base du couple 1 et l'acide du couple 2.
A1 + B2 = B1 + A2
exemple : HNO3(aq)
+ H2O(aq) = NO3-(aq) + H3O+(aq)
couples acide
base : HNO3(aq)
/ NO3-(aq) ; H3O+(aq) / H2O(aq)
II) Définition du pH
Le pH d'une solution est égal à l'opposé du
logarithme décimal de la concentration en ion oxonium :
pH = -log[H3O+]
ou [H3O+] = 10-pH
exemple : [H3O+]
= 10-4 mol.L-1 pH = -log[H3O+] =
-log 10-4 = 4
pH =3,5 , [H3O+]
= 10-pH
III) Etat d'équilibre d'un système
chimique
1)
Réaction chimique partielle
Lorsqu'une
réaction chimique est partielle, son avancement final, xf,
est inférieur à son avancement maximal xmax
:
Réaction
partielle : xf < xmax
2) Taux
d'avancement final
![]()
Si tf = 0, la réaction n'a pas lieu.
3) Etat d'équilibre d'un système
chimique
Une fois l'équilibre chimique obtenu, les proportions
en réactifs et produits ne changent plus. On peut déterminer le taux
d'avancement final. On se trouve à l'état d'équilibre du système chimique.
IV) Le quotient de réaction
a.A(aq) + b.B(aq) = c.C(aq) + dD(aq)
Avec a, b, c, d nombres stœchiométriques
et A, B, C et D réactifs et produits. Le quotient de réaction Qr de cette réaction (à un instant quelconque de son
évolution) est :
![]()
Par convention le solvant (eau) et
les corps solides n'interviennent pas dans le quotient de réaction. On admettra que le quotient de réaction est sans
unité. Les concentrations sont exprimées en mol.L-1.
exemple : HA(aq) + HO–(aq) =
A–(aq) + H2O(l)
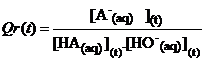
V) la constante d’équilibre
Lorsqu'un système chimique atteint son état
d'équilibre (les concentrations en réactifs et produits n'évoluant plus) sa
constante de réaction est : Qr(équilibre) = Qreq
= K
K est appelé la constante
d'équilibre de la réaction. À la différence du taux d'avancement elle ne dépend
pas de la composition initiale du système. Elle n'est fonction que de la
température.
Soit la réaction :
a.A(aq)+b.B(aq)=c.C(aq)+d.D(aq)
La constante d'équilibre K est:
![]()
K est sans unité. Par
convention le solvant (eau) et les corps solides n'interviennent pas dans
l'expression de la constante d'équilibre. vidéo
A l'équilibre l'avancement est égal à
l'avancement final : x(eq) = x(f)
exemple : 2I-(aq) + S2O82-(aq) =
I2(aq) + 2SO42-(aq) 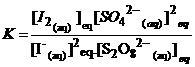
Chapitre 5 : constante d'acidité
d'un couple acide base
I) Produit
ionique de l'eau
1) Autoprotolyse de l'eau
La réaction d'autoprotolyse de l'eau est :
H2O(L)
+ H2O(L) = H3O+aq+
HO-aq
L'eau pure possède un pH
= 7 à
La réaction
d'autoprotolyse de l'eau est très limitée ( son taux d'avancement final tauf est très inférieur à 1).
2) Produit ionique de l'eau Ke
La constante d'équilibre, notée Ke, correspondant à l'autoprotolyse de l'eau, est appelée
produit ionique de l'eau. À
En généralisant
dans toute solution aqueuse, le produit ionique de l'eau à
Ke = [H3O+]eq[HO-]eq=10-14
et pKe = -log(Ke) = 14
Unité : les
concentrations en mol.L-1 , le produit
ionique est sans unité.
Ke ne dépend pas des espèces chimiques en solution
aqueuse mais de la température.
pKe
= -log(Ke) = -log([H3O+]eq[HO-]eq ) =
-log([H3O+]eq –log([HO-]eq
pH = pKe +
log([HO-]eq) ; [HO-]eq = 10(pH - pKe)
exemple :
[HO-]eq = 10-4 mol.L-1
pH = pKe + log([HO-]eq) = 14 + log 10-4
= 14-4 = 10
Vidéo :
exemple de calcul de Ke.
3) Solution chimiquement
neutre acide et basique,
Dans une solution
neutre chimiquement : [H3O+]eq = [HO-]eq
, pH = pKe + log([HO-]eq)
= pKe - pH
pH =
1/2.pKe
Dans une solution acide :
[H3O+]eq > [HO-]eq , pH < 1/2.pKe
Dans une solution
basique:[H3O+]eq
< [HO-]eq , pH >
1/2.pKe
exemple : pKe = 14
solution acide :
[H3O+]eq > [HO-]eq , pH < 1/2.pKe
donc pH < 7
solution basique: [H3O+]eq < [HO-]eq , pH > 7
solution neutre pH = 7
II) Constante
d'acidité Ka d'un couple acide base
1) Définition
Soit un couple acide
base HA/A- dont la réaction avec l'eau est : HAaq + H2O = A-aq + H3O+aq
La constante d'équilibre,
Ka, appelée constante d'acidité de ce couple est :

III) Diagramme
de prédominance et de distribution
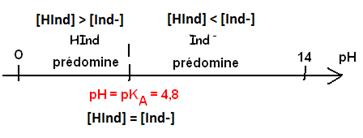
1) Zone de prédominance des espèces vidéo
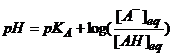
Si l'acide et la base conjuguée
ont la même concentration alors ; pH = pKA.
Si pH > pKa
la base est l'espèce prédominante.
Si pH < pKA
l'acide est l'espèce prédominante.
 exemple : diagramme
de prédominance du couple HInd/Ind-
avec pKA = 4,8
exemple : diagramme
de prédominance du couple HInd/Ind-
avec pKA = 4,8
2) Diagramme de distribution des espèces
acide et basique
Le diagramme de distribution des espèces acide
et basique, représente les pourcentages de l'acide et de sa base
conjuguée, en fonction du pH de la solution.
 exemple : AH/A- ;
pKA = 7,3
exemple : AH/A- ;
pKA = 7,3
3) Indicateurs colorés
Les indicateurs colorés sont constitués par des
couples acide base. Les espèces conjuguées ont des teintes différentes.
pH < pKa-
pH > pKa+
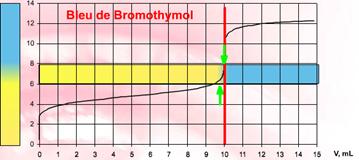
exemple :
bleu de bromothymol
|
Zone
de pH |
0 < pH < 6
|
6 < pH <
7,6 |
7,6 < pH <
14 |
||
|
Couleur |
Jaune |
Vert |
Bleu |
||
Chapitre 6 : réaction acido-basique,
titrage
I) Titrage pHmétrique
1) Constante d'équilibre d'une
réaction acido-basique
Soient deux couples acide base A1/B1 et A2/B2,
de constante d'acidité respective Ka1 ,Ka2.
La constante d'équilibre K de cette réaction
est :
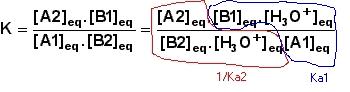
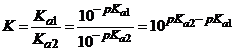
2) Relation entre les quantités de
matière d'acide et de base à l'équivalence
Une réaction de dosage est quasi totale (
K > 103 )
a.A1 + b.B2 = c.B1 + d.A2
À l'équivalence les réactifs ont été introduits dans les proportions
stœchiométriques et ont entièrement réagit.
![]()
exemple : réaction de dosage de l’acide chlorhydrique (H3O+,Cl-) par la soude (Na+,HO-)
H3O+ + HO-
= 2H20
A l’équivalence n(acide
initial) = n(soude versé équivalence)
Ca.Va(initial) = Cb.VbE
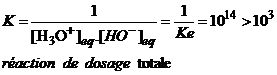
Une réaction de
dosage est instantanée
II) Dosage d'un acide par une base
1) Courbe pH-métrique pH = f(Vb)
Animation :
dosage pHmétrique, courbes pHmétriques
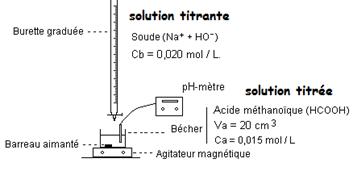 On effectue le dosage d'un acide par une base
On effectue le dosage d'un acide par une base
Lors du dosage d'un acide par une base,
l'équivalence est le point de la courbe pH = f(Vb) où
la pente de la tangente est maximale :
2) Méthodes pour déterminer le
volume de base versée à 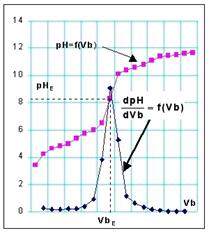 l'équivalence
l'équivalence
Méthode 1:
1) Tracer la courbe pH = f(Vb)
2) Calculer avec un logiciel la fonction (dpH/dVb)=f(Vb)
3) En déduire graphiquement VbE. La valeur de VbE
correspond à la valeur maximale de la dérivée du pH par rapport au volume de
base versée (dpH/dVb)max.
Méthode 2:
méthode dite "des tangentes
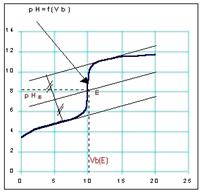 1) Tracer 2 tangentes à la
courbe, parallèles entre elles, de part et d'autre du point d'équivalence.
1) Tracer 2 tangentes à la
courbe, parallèles entre elles, de part et d'autre du point d'équivalence.
2) Tracer la parallèle équidistante de ces deux tangentes.
3) l'intersection de cette parallèle avec la courbe
pH = f(Vb) donne le point d'équivalence E(VbE;pHE).
Méthode 3: indicateurs colorés
1. Utiliser un indicateur coloré dont la zone
de virage contient le pH à l'équivalence.
2. Verser la solution titrante.
Quand la solution à doser change de couleur on se trouve à l'équivalence.
3. Relever le volume de solution titrante VbE
 III) Dosage d'une solution de base par un
acide
III) Dosage d'une solution de base par un
acide
Lors du dosage d'une base par un acide, le
volume à l'équivalence est donné par le point équivalent E. En ce point la pente de la tangente à la courbe est 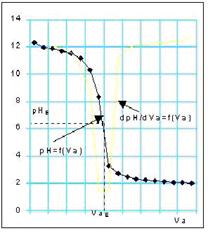 minimale (car négative).
minimale (car négative).
3) Caractéristiques d'une réaction
de titrage
Une réaction de titrage (ou dosage)
doit être instantanée et totale :
- le taux d'avancement égale à 1
- constante d'équilibre K > 103