C) Le sens d'évolution chimique d'une
réaction est-il prévisible ? Peut-il être inversé ?
7 : sens d'évolution spontanée d'un système chimique
9 : Electrolyse, une transformation forcée
chapitre 7 : sens d'évolution spontanée
d'un système chimique
Soit la réaction
d'équation bilan :
a.A(aq)
+ b.B(aq) = c.C(aq) + d.D
Son quotient de réaction initial est noté
Qr(i) :
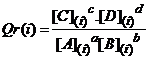
Le sens direct correspond à l'écriture de
gauche à droite de l'équation bilan. Pour
déterminer l'évolution spontanée du système, 3 cas peuvent se présenter :
1) Qr(i) = K

Si le quotient de réaction initial est égal à
la constante d'équilibre alors le système est déjà en équilibre et n'évolue pas
: les concentrations initiales en espèces A, B ,C , D ne changent pas,
l'avancement x de la réaction est nul.
Si Qr(i) = K pas d'évolution.
2)
Qr(i) < K
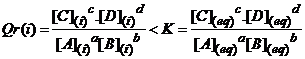
Lorsque le
quotient de réaction initiale Qr(i ) est inférieur à la constante d'équilibre
K, alors le système évolue dans le sens direct de l'écriture de l'équation de
la réaction jusqu'à l'équilibre. L'avancement de la réaction à l'équilibre xeq
est positif.
Si Qr(i) < K, réaction spontanée
dans le sens direct
3) Qr(i) > K
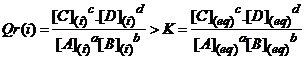
Lorsque le quotient de réaction initiale Qr(i)
est supérieur à K, le système évolue dans le sens inverse de l'écriture de
l'équation de la réaction, jusqu'à l'équilibre.
L'avancement à l'équilibre de la réaction sera
négatif. Les espèces C et D vont être consommées, alors que les espèces A et B
vont être produites.
Si Qr(i) > K évolution spontanée
dans le sens inverse
Conclusion : sens d'évolution d'un système
chimique

chapitre
8 : les piles
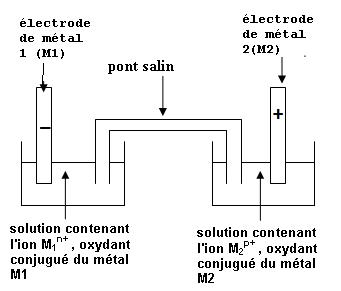
I) Constitution d'une pile
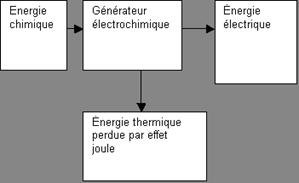
1) schéma
Une pile (générateur
électrochimique) est constituée de deux compartiments distincts contenant
chacun un couple oxydant/réducteur M1n+/M1 et M2p+/M2
. Les 2 compartiments sont reliés par un pont salin imbibé de solution ionique.
Les plaques de métal sont appelées les électrodes.
2) Symbole d'un pile
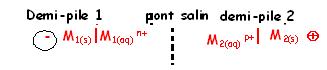
- exemple : pile cuivre zinc

II) Le générateur
électrochimique est un convertisseur énergie.
III) Fonctionnement d'une pile
1) Principe vidéo
1) Les électrons sortent de l'électrode constituant
le pôle négatif de la pile. Cette
demi-pile est le siège d'une oxydation.
2) Les électrons entrent par l'électrode
constituant le pôle positif de la
pile. Cette demi-pile est le siège d'une
réduction.
3) Les
électrons se déplacent dans les électrodes et les conducteurs qui les relient.
Le sens conventionnel du courant i est du pôle + au pôle - de la pile (sens
inverse de celui des électrons).
4) A l'intérieur de la pile (solutions et pont
salin), les cations se déplacent dans le sens du courant et les anions dans le
sens inverse.
5) La concentration des ions présents dans le
compartiment du pôle + diminue et inversement pour ceux présents dans le
compartiment du pôle - .
6) la pile ne débite plus de courant dans les cas
suivant :
- lorsque le quotient de
réaction Qr est égal à la constante d'équilibre k de la réaction, l'équilibre est alors atteint,
Si Qr = k alors I = 0 A
- lorsque l’un des réactifs est entièrement
consommé
exemple : pile cuivre zinc
à la borne + réduction des ions cuivre Cu2+(aq) + 2 e- = Cu(s)
à la borne – oxydation du métal zinc Zn(s) = Zn2+(aq)+ 2e-
équation de fonctionnement de la pile
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
2) Force électromotrice d'une pile
La force électromotrice (f.e.m)
d'une pile notée E, est égale à la différence de potentiel électrique entre les
deux compartiments, quand la pile ne débite aucun courant
(i = 0 A) : E = (VM2- VM1 ) i = 0
VM2 et VM1
potentiels respectifs des plaques de métal M2 et M1. Unité: le volt(V).
exemple : la force électromotrice d’une pile cuivre zinc est E
= 0,9 V environ.
Rappel : UPN = E – r.I (r : résistance interne de la pile)
IV) Quantité d'électricité Q fournie par la pile
1) le faraday F
Un faraday F correspond à la
charge électrique transportée par une mole d’électron :
q = N.e = 6,02x1023x1,60x10-19
= 9,65x104 C
![]()
2) calcul de la quantité
d’électricité Q débitée par une pile
2 méthodes pour la
calculer :
- La quantité d'électricité Q
que peut débiter une pile est égale au nombre N d'électrons fournis, multiplié
par la valeur absolue de la charge d'un électron (e).
Q = N.e = n.Na.e = n.F
unité : Le faraday : F =
96500 C.mol-1 ; Nombre d'Avogadro Na = 6,02.1023
mol-1 ; n(mol): nombre de mole
d'électrons.
- une pile débitant un courant
d'intensité I constant pendant une durée
![]() fournit une
quantité d'électricité Q:
fournit une
quantité d'électricité Q:
![]()
unité : I(A) ; ![]() (s) ;Q(C)
(s) ;Q(C)
3) capacité Q(max)
d'une pile : vidéo.
La capacité Qmax
d’une pile est la quantité maximale d'électricité qu'elle peut fournir.
exemple : une pile est
complètement déchargé lorsqu’elle a débité un courant d’intensité I = 100 mA
pendant ![]() =3h ; sa capacité est :
=3h ; sa capacité est :
Qmax = I. ![]() =0,1x3x3600 = 1,08x103 C
=0,1x3x3600 = 1,08x103 C
Chapitre 9 : electrolyse, une transformation forcée
I) L'électrolyse
1) Définition vidéo.
Soit un système chimique pouvant évoluer
spontanément dans le sens direct de la réaction d'oxydoréduction suivante:
Ox1 + red2 = red1+ Ox2
avec les 2 couples Ox1/red1 , Ox2/red2
Pour faire évoluer le système dans le sens
inverse, il faut lui fournir un courant électrique délivré par un générateur.
Celui-ci doit envoyer un courant i dans le sens inverse de celui fourni lorsque
le système évolue spontanément . Cette transformation forcée est
appelée une électrolyse. Elle se déroule dans un électrolyseur.
L'électrode où se produit l'oxydation est appelée anode
(qui attire les anions) celle où se produit la réduction
est appelée cathode (qui attire les
cations). vidéo.
exemple : La réaction suivante n’a pas lieu spontanément :
Zn2+(aq) + Fe(s) = Fe2+(aq) +  Zn(s) K =10-11. Pour la forcer on
réalise une électrolyse d’une solution de sulfate de zinc.
Zn(s) K =10-11. Pour la forcer on
réalise une électrolyse d’une solution de sulfate de zinc.
à l’anode réduction des ions
zinc : Zn2+(aq) + 2e- = Zn(s)
à la cathode oxydation du métal fer : Fe(s) = Fe2+(aq) + 2e-
équation de fonctionnement de
l’électrolyse :
Zn2+(aq) + Fe(s) = Fe2+(aq) +
Zn(s)
2) Sens d'évolution du quotient
de réaction
Pour une transformation forcée, le quotient de
réaction du système chimique Qr s'éloigne de la constante d'équilibre K (c'est
l'inverse pour la pile).
3) Méthode pour l'équation chimique
d'une électrolyse
1) Ecrire les espèces chimiques présentes en
solution.
2) Ecrire les couples oxydant réducteur
et entourer les espèces présentes en solution.
3) Déterminer les réactions possibles à
l'anode (oxydation) et à la cathode (réduction).
4) Choisir la réaction d'oxydation et
de réduction par l'observation ou les tests.
5) En déduire l'équation produite au
cours de l'électrolyse.
II) Quantité d'électricité Q fournie
à l'électrolyseur
Soit un générateur fournissant un courant
d'intensité I constant à un électrolyseur, pendant une durée Dt. La quantité d'électricité Q débitée est :
Q = I.D t = n(e-).F
Avec : Q :
quantité d'électricité en coulomb (C) ;
I : intensité en ampère (A) ; Dt : durée en seconde (s) ;
n(e-): quantité de matière
d'électrons fournis par le générateur en mole (mol) ;
F : charge par mole d'électron égale à un
Faraday 1 F = 96500 C.mol-1.