D) Comment le chimiste contrôle-t-il les transformations de la
matière ?
11 : Contrôle de
l'évolution d'un système
Chapitre 10 : estérification hydrolyse
I) Les esters
1) Définition
Un ester est un composé organique qui possède
le groupe caractéristique :
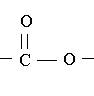
La formule générale des 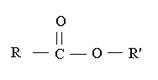 esters s'écrit :
esters s'écrit :
Avec R = H ou chaîne carbonée et R' = chaîne carbonée.
2) Nomenclature
Rappel sur les cinq premiers alcanes :
CH4
méthane ; CH3-CH3 éthane ; CH3-CH2-CH3
propane ; CH3-CH2-CH2-CH3
butane ; CH3-CH2-CH2-CH2-CH3
pentane
moyen mnémotechnique : maman est partit
bébé pleure
La première partie désigne la chaîne carbonée
contenant le carbone fonctionnel : on remplace la terminaison otique de l'acide
carboxylique correspondant par "oate". La seconde partie désigne la
chaîne liée à l'atome d'oxygène: elle est nommée comme un radical alkyle.
vidéo
exemple : l’éthanoate
d’ethyle
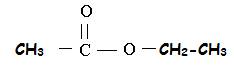
II) Equilibre d'estérification
hydrolyse
1) Caractéristiques de la réaction
d'estérification vidéo
On réalise un mélange d'acide carboxylique et
d'alcool. La réaction produit un ester et de l'eau suivant l'équation bilan suivante
:
R-CO2H + R'-OH = R-CO2-R' + H2O
La réaction
d'estérification est lente, limitée, athermique.
Son taux d'avancement final tauf est
inférieur à 1.
exemple : acide
éthanoïque + éthanol donne eau + éthanoate d’éthyle
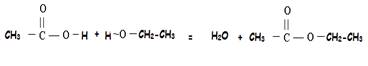 2) Caractéristiques
de la réaction d'hydrolyse d'un ester La
réaction inverse de la réaction d'estérification est appelée réaction
d'hydrolyse. À partir d'un ester et de l'eau on produit un acide carboxylique
et un alcool. Son équation bilan est :
2) Caractéristiques
de la réaction d'hydrolyse d'un ester La
réaction inverse de la réaction d'estérification est appelée réaction
d'hydrolyse. À partir d'un ester et de l'eau on produit un acide carboxylique
et un alcool. Son équation bilan est :
R-CO2-R'+H2O =
R-CO2H+R'-OH
L' hydrolyse d'un ester est une réaction lente, limitée, athermique. Son taux d'avancement
final est inférieur à un.
3) L'équilibre d'estérification
hydrolyse
La réaction d'estérification est la réaction
inverse de l'hydrolyse de l'ester. Ces deux réactions se limitent
mutuellement. La
constante d'équilibre K de la réaction d'estérification est :
![]()
La constante d'équilibre K' de la
réaction d'hydrolyse de l'ester est l'inverse
de celle de l'estérification :
![]()
L'eau est un des produits de la réaction et
non plus le solvant : il faut faire intervenir sa concentration dans la
constante d'équilibre.
exemple :
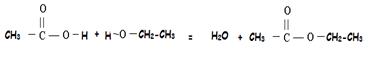
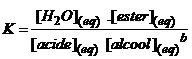
III) Facteurs permettant d'atteindre
plus rapidement l'état d'équilibre
1) Influence de la température
L'augmentation de température
augmente la vitesse de la réaction d'estérification ou d'hydrolyse, mais ne
modifie pas leur rendement (car la réaction est athermique).
L'augmentation de température
permet d'atteindre plus rapidement l'état d'équilibre.
2) Influence d'un catalyseur
Un catalyseur permet d'atteindre
plus rapidement l'état d'équilibre de la réaction d'estérification ou d'hydrolyse,
mais ne modifie pas
le rendement de la réaction.
IV) Amélioration du rendement d'une
estérification
1) Rendement d'une réaction
Soit la réaction suivante : a.A +
b.B = c.C
Si le réactif A est en
excès Le rendement 'r' de la réaction est :

2) Utilisation d'un réactif en excès
En augmentant l'excès d'un des réactifs (acide
ou alcool) de la réaction d'estérification, on
augmente son rendement, et son taux d'avancement final.
3) Elimination d'un produit formé
 Une fois l'équilibre d'estérification atteint, en
éliminant l'ester ou l'eau formé(e), le quotient de réaction Qr devient
inférieur à la constante d'équilibre K.
Une fois l'équilibre d'estérification atteint, en
éliminant l'ester ou l'eau formé(e), le quotient de réaction Qr devient
inférieur à la constante d'équilibre K.
Le système évolue à nouveau dans le sens
direct de la réaction d'estérification. Le
rendement est amélioré car le nombre de mole de réactif en défaut
diminue.
4) Influence des réactifs
La constante
d'équilibre K et le rendement d'une réaction d'estérification dépend de
l'alcool utilisé
alcool primaire r
= 66%
alcool secondaire
r = 60%
alcool tertiaire
r = 5%
Chapitre 11 : Contrôle de l'évolution
d'un système
I) Estérification et hydrolyse
totale
1) Estérification totale :
utilisation d'un anhydride d'acide
La réaction d'un anhydride d'acide avec un
alcool est totale et rapide. Elle fournit un acide carboxylique et un ester. Le taux d'avancement final est égal à 1.
tauf = 1 = xf/xmax
xf = xmax
Equation
bilan :
R-CO-O-CO-R + R'-OH = R-CO-O-R' + R-COOH
Pourquoi la réaction est-elle totale ?
L'absence d'eau dans le système rend impossible la réaction inverse d'hydrolyse
de l'ester !
exemple :
2) Hydrolyse totale des esters
L'hydrolyse en milieu basique, ou réaction de saponification
d'un ester, forme un alcool et un ion carboxylate. Cette réaction se produit
dans une solution concentrée d'ions hydroxyde HO-, et à température
élevée. Cette réaction est assez rapide et totale. Son taux
d'avancement final est égal à un :
tauf = 1 = xf/xmax
xf = xmax
Équation
bilan : R-CO-O-R' +
HO- =R-CO2- +R'-OH
II) Savon : produit de la
saponification
1) Qu'est-ce qu'un savon ?
Un savon est un mélange de carboxylate de
sodium ( ou de potassium). La chaîne carbonée non
ramifiée (saturée ou non) possède au moins dix atomes de carbone.
Formule générale des savons :
RCOO- + Na+ 'savon dur' ;
RCOO- + K+ 'savon mou' ;
2) Fabrication des savons vidéo
Les savons sont obtenus par réaction d'esters
gras, appelés triglycéride, avec l'ion hydroxyde HO-. Cette réaction
se nomme la saponification.
triester + hydroxyde de potassium ou sodium =
carboxylate de sodium ou potassium + propan-1,2,3-triol (glycerol)
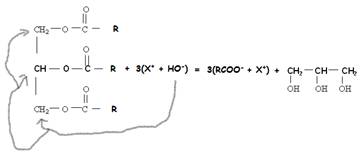 X : Na+(sodium) ou K+
potassium
X : Na+(sodium) ou K+
potassium
exemple :
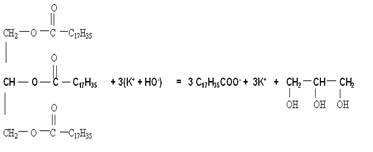
3) Caractères
hydrophile et lipophile des ions carboxylate
Le groupe carboxylate est polaire du
fait de la différence d'électronégativité entre l'oxygène et le carbone. Ce
groupe s'entoure facilement de molécules d'eau polaire. On dit qu'il est
hydrophile (du grec hudor : eau et philos : ami). Par contre il n'attire
pas les chaînes carbonées présentes dans les graisses car il y a très peu de
différence d'électronégativité entre le carbone et hydrogène : la liaison
carbone hydrogène n'est pas polaire. Ce groupe est lipophobe (du grec lipos :
graisses et phobos : peur).
IV) influence de la température, et
du catalyseur
1) Influence de la température
Suivant la température, on peut privilégier
une réaction au profit d'une autre. Le choix de la température permet dans
certain cas de sélectionner le produit à obtenir.
2) Définition d'un catalyseur
Un catalyseur est une espèce
chimique qui accélère une réaction chimique sans intervenir dans son équation
bilan.
Il ne modifie pas :
* la constante d'équilibre du système
* le sens d'évolution de la réaction chimique
Il modifie :
* la vitesse de réaction dans le sens direct
et inverse.
* les différentes étapes réactionnelles
permettant de passer des réactifs au produit.
Lorsque le réactif et le catalyseur font
partie de la même phase (solide liquide eau gazeuse) la
catalyse est dite homogène. La réaction se déroule dans tout le
réacteur, Plus la concentration du catalyseur est élevée que la vitesse de
réaction est importante.
Lorsque
le catalyseur et le réactif sont dans des phases différentes la catalyse est hétérogène. La réaction se déroule à
la surface du catalyseur. Plus elle est importante plus la vitesse est rapide.
La catalyse est enzymatique lorsque le
catalyseur est une enzyme. C'est une protéine
présentant des cavités appelées sites actifs, sur lesquels les réactifs se fixent
pour réagir. Plus le nombre de sites est important, plus la vitesse est
importante.
3) Pourquoi le catalyseur
accélère-t-il la réaction?
En règle générale, le catalyseur ne modifie que
les réactions successives permettant de passer des réactifs aux produits. Il
remplace une réaction lente par plusieurs réactions rapides.
4) Sélectivité d'un catalyseur
A partir des mêmes réactifs, et suivant la
nature du catalyseur, on obtient des produits différents.