Propriétés
de l’acide propanoïque (bac 2005 Pondichéry) énoncé
Q1
Préparation par
dilution. Exercice similaire clique ici
Concentration de
la solution mère S0 ..
![]() .
.
Solution fille : C = 2,0.10-3 mol.L-1 ; V =
Au cours de la
dilution la quantité de matière no
d’acide propanoïque prélevée dans la solution
mère est égale à celle contenue dans la
solution fille (n = C.V) :
no = n Þ C0´V0 = C´V :
![]()
On prélève 10 mL
d’acide propanoïque de la solution S0, à
l’aide d’une pipette jaugée de 10 mL surmonté du pipeteur.
On verse la solution dans une fiole jaugée de 1000 mL et on ajoute de l’eau
distillée au trois-quarts. On agite puis on complète, avec de l’eau distillée,
jusqu’au trait de jauge.
b) Vidéo
Formule développée
de l’acide propanoïque

c) Réaction
acido-basique entre l’acide propanoïque et
l’eau :
AH(aq) + H2O(l)
=
A–(aq) + H3O+(aq)
Q2
a) Tableau
d’avancement de la réaction .
|
Équation
chimique |
AH(aq) +
H2O(l) =
A–(aq) +
H3O+(aq) |
||||
|
État du système |
Avancement (mol) |
Quantités de
matière (en mol) |
|||
|
État initial |
0 |
n0 =
2,0.10-3 |
Excès |
0 |
0 |
|
État final |
xéq |
n0 – xéq |
Excès |
xéq |
xéq |
b) Vidéo
Expression de la
conductivité :
s = l1.[H3O+(aq)]éq + l2.[A–(aq)]éq
D’après le tableau
d’avancement les concentrations à l’équilibre sont :
[A–(aq)]éq = [H3O+(aq)]éq = xeq / V
s = l1.xeq/V + l2.xeq /V
![]()
c) Vidéo
D’après la
relation précédente :
![]()
*Calcul de xeq attention il faut convertir les volumes en m3 :
![]()
![]()
![]()
c) Constante
d’acidité du couple acide base :

pKA = –log(KA) = 4,8
Q3
a)
Vidéo
Réaction d’estérification
de l'acide avec un alcool.
C3H6O2
(aq)
+ C4H10O
(aq) = H2O
(l) + C7H14O2
(aq)
b) Nom des produits formés :
Eau : H2O

Q4
a) Vidéo
Tableau
d’avancement de la réaction d’estérification
|
Équation
chimique |
C3H6O2 (aq)
+ C4H10O
(aq)
= H2O (l) + C7H14O2 (aq) |
||||
|
État du système |
Avancement (mol) |
Quantités de matière (en mol) |
|||
|
État
initial |
0 |
n0 = 0,20 mol |
n0 = 0,20 mol |
0 |
0 |
|
En
cours de transformation |
x |
n0 – x |
n0 – x |
x |
x |
Expression du quotient
de réaction en fonction de no et x :
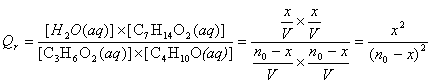
Remarque :
l’eau
n’est pas un solvant, c’est l’un des produits de la réaction : sa concentration
intervient dans l’expression de la constante de réaction.
b)
Détermination de xeq
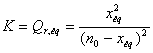
K.´(n0 – xéq)2
= x2éq ou
K.(n02 –2´n0´xéq + xéq2) = x2éq
(K
– 1)´x2éq –2´K´n0´xéq +K´n02 = 0
3
x2éq –1,6.xéq + 0,16 = 0
Il
suffit de résoudre l’équation du second degré en ‘xeq’
D = 1,6² – 4´3´0,16 = 0,64
Solutions :
xéq1
= 0,13 mol
xéq2
= 0,4 mol
Or
![]() et xmax = n0
= 0,20 mol
et xmax = n0
= 0,20 mol
Donc
xéq = 0,13 mol.
c) Calcul du taux d’avancement
final :
![]()
Le taux d’avancement final est de 65%
d) Vidéo
L’augmentation de température et le catalyseur augmente la vitesse de
réaction mais n’influe pas sur le taux d'avancement final.
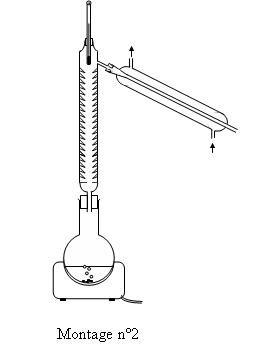
Par contre en éliminant un des produits formés on
déplace l’équilibre dans le sens de la formation des produits. xéq
augmente. On utilisera Le montage de distillation nécessaire pour éliminer
l'eau (2).
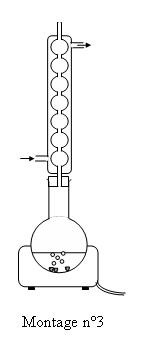
Le chauffage à reflux
permet d’éviter de perdre des réactifs et produits (ils refluent dans le
ballon) : le taux d'avancement( et donc le rendement) est amélioré.