Chapitre 10 : estérification hydrolyse
Propriétés de l’acide propanoïque (bac 2005 Pondichéry) corrigé
On se propose d’étudier deux propriétés chimiques différentes de l’acide propanoïque dans deux parties indépendantes : la réaction de dissolution dans l’eau et la réaction avec l’alcool butan-1-ol.
Données :
Le tableau ci-dessous rassemble quelques propriétés physico-chimiques des réactifs et des produits.
|
|
Formule brute |
Masse volumique |
Masse molaire |
Température d’ébullition |
|
Acide |
C3H6O2 |
1,00.103 kg.m-3 |
|
|
|
Butan-1-ol |
C4H10O |
8,10.102 kg.m-3 |
|
|
|
Ester |
|
|
||
|
Eau |
|
|
||
Dans ce qui suit, l’acide propanoïque est noté AH et l’ion propanoate A–. Le conductimètre utilisé permet de mesurer la conductivité s de la solution étudiée, proportionnelle à sa conductance G. On considère une solution aqueuse d’acide propanoïque. On néglige la concentration en ions hydroxyde HO– par rapport à celles des autres espèces ainsi que leur contribution à la conductivité de la solution. Dans ces conditions, la conductivité s de la solution est de la forme :
s = l1.[H3O+] + l2.[A–]
- l1 conductivité molaire ionique de l’ion H3O+ : l1 = 35,0.10-3 S.m2.mol-1
- l2 conductivité molaire ionique de l’ion propanoate : l2 = 3,58.10-3 S. m2.mol-1
Ces valeurs sont données à
1. Etude de la réaction entre l’acide propanoïque et l’eau
Q1
a) On verse 0,10 mole d’acide
propanoïque pur dans de l’eau pour obtenir 500 mL d’une solution notée S0.
Pour des mesures de conductimétrie, il est nécessaire de disposer de solutions
moins concentrées. On souhaite donc obtenir V =
b) Ecrire la formule développée de l’acide propanoïque. On utilisera ensuite les abréviations précisées dans les données.
c) Ecrire l’équation de la réaction chimique entre l’acide propanoïque et l’eau.
Q2
a) Dresser un tableau
d’avancement de la transformation de 2,0.10–3 mol d’acide
propanoïque dans un volume d'eau tel qu’on obtient V =
b) Etablir la relation entre la conductivité s de la solution, les conductivités molaires ioniques l1 et l2, le volume V et l’avancement xéq à l’équilibre.
c) La mesure au conductimètre donne s = 6,20 . 10–3 S.m–1. Déterminer la valeur numérique de xéq. En déduire les valeurs numériques des concentrations [A–]éq et [H3O+]éq à l’équilibre. Quelle est la concentration de l’acide propanoïque [AH]éq à l’équilibre ?
d) Rappeler l’expression de la constante d’acidité Ka du couple acide propanoïque / ion propanoate et la calculer. En déduire le pKa de ce couple.
2. Réaction de
l’acide avec un alcool
Q3
a) On prélève 0,20 mole d’acide propanoïque pur et 0,20 mole de butan-1-ol pur qu’on verse dans un ballon. Comment s’appelle la réaction qui a lieu entre ces deux réactifs ? Ecrire l’équation de cette réaction chimique. On pourra utiliser les formules brutes (voir le tableau « Données » au début du sujet).
b) Donner le nom des produits formés et leur formule semi-développée.
Q4
a) Dresser un tableau d’avancement de la transformation. En déduire l’expression du quotient de réaction Qr en fonction de l’avancement x à la date t.
b) Calculer l’avancement à l’équilibre xéq sachant que la constante d’équilibre K = 4,0.
c) En déduire le taux d’avancement t final de la réaction.
d) On demande à un groupe d’élève de formuler des propositions pour augmenter le taux d’avancement. On relève les propositions suivantes :
1 : On chauffe le milieu réactionnel pendant 5 minutes.
2 : On ajoute un catalyseur : l’acide sulfurique concentré par exemple.
3 : On réalise une distillation pour éliminer l’eau.
4 : On chauffe à reflux.
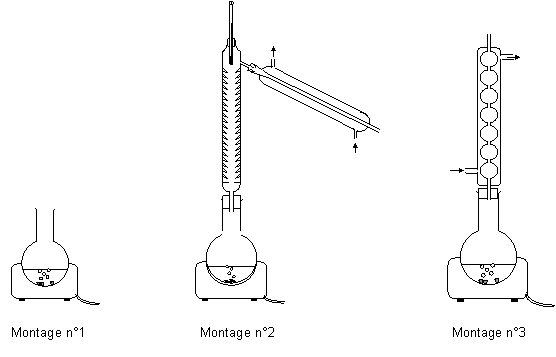
Parmi ces quatre
propositions, choisir en justifiant celle qui vous semble correcte. Quel
montage réaliserez vous parmi ceux qui sont proposés ci-dessous ?