L'acide ascorbique (vitamine C) énoncé
Q1
Equation bilan:
C6H8O6(aq) +
H20 = C6H7O6-(aq)
+ H3O+(aq)
Remarque: ne pas oublier la notation 'aq' qui signifie que les espèces
sont en solution aqueuse.
On se servira de cette information pour
déterminer la constante de réaction.
Q2
Réponse partielle, pour voir la correction, clique
ici.
Le nombre de moles d'ions oxonium initial est très faible donc
négligeable devant les autres quantités de matière.
Q3
Réponse partielle, pour voir la correction, clique
ici.
[H30+]f = [C6H7O6-
]f = 6,3 x 10-4 mol.L-1
[C6H8O6]f= 4,4 x 10-3
mol.L-1
Q4
Réponse partielle, pour voir la correction, clique ici.
Le taux d'avancement final est :
tf = 0,13
La réaction n'est pas totale, tf < 1.
Q5
Attention, pour calculer le quotient de réaction Qr, remplacer toujours
la concentration du solvant (l'eau) par 1.
Le quotient de réaction est sans unité.
Données:
x = 10-5 mol; V = 0,25L;

Le quotient de réaction est égal à 3,23 x 10-7.
Remarque: Le quotient de réaction est inférieur à la constante d'équilibre
K, car l'avancement x est inférieur à l'avancement final xf.
Q6
Attention, pour calculer le quotient de réaction à l'équilibre Qrf
ou Qreq (alors appelé constante d'équilibre K), remplacer
l'avancement x par l'avancement final xf.
En effet l'équilibre est atteint quand la
réaction est terminée!
Données:
xf =1,6.10-4 mol; V = 0,25 L

xf/V = [H3O+] f
= 10-pH , K peut s’exprimer de la manière suivante :
![]()
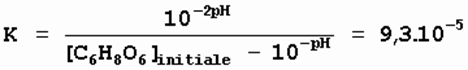
La constante d'équilibre K est égale à 9,3.10-5 .
Remarque: les résultats seront donnés avec 2 chiffres significatifs, car
le pH-mètre n'est précis qu'à une décimale près.
Q7
Avant d'utiliser le pH-mètre :
Le pH-mètre doit être préalablement étalonné à l'aide de 2 solutions
étalons de pH précis (généralement pH = 4 et pH = 7 ).
La sonde doit être rincée à l'eau distillée après chaque mesure, et
réintroduite si nécessaire dans la solution de conservation.