ÉTUDE D’UNE SOLUTION DE CHLORURE D’HYDROXYLAMMONIUM (4 pts) énoncé
2009
Polynésie
1.
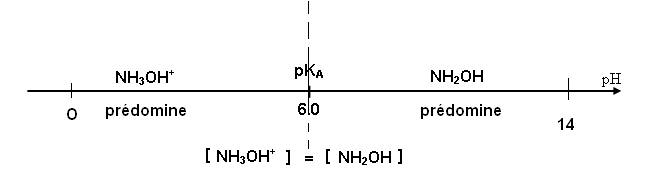
Étude du couple ion hydroxylammonium / hydroxylamine.
1.1. Dissolution
du chlorure d’hydroxylammonium dans l’eau.
NH3OHCl(s) = NH3OH+(aq) + Cl–(aq)
1.2.1.
Un acide au sens de Brønsted, est une espèce
chimique capable de céder un proton H+.
1.2.2.NH3OH+(aq) + H2O(l) = NH2OH(aq) + H3O+(aq) (1)
1.2.3.
2. Dosage de la
solution S
2.1.

2.2.
réaction de dosage entre les ions hydroxylammonium NH3OH+(aq)
et les ions hydroxyde HO-(aq) :
NH3OH+(aq) + HO–(aq) = NH2OH(aq) + H2O(l) (2)
2.3.1.
À l’équivalence, les réactifs sont alors introduits dans les proportions
stœchiométriques.
.et ont totalement réagit
2.3.2.
La zone de virage de l’indicateur coloré doit contenir le pH à
l’équivalence : on choisirat la phénolphtaléine
8,2 (solution incolore) < pHE = 9,1
< 10,O (solution rose)
La solution acide initialement incolore, deviendra rose une fois passée l’équivalence.
![]()
2.3.3.
À l’équivalence la quantité de matière d’hydroxyde
de sodium de sodium versée est égale à la quantité d’acide présente
initialement :
nBéq = nA
CB.VBéq = CA.VA
![]()
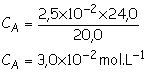
3.
Avancement de la réaction (1) de l’ion hydroxylammonium avec l’eau.
3.1.
pH = 3,8 :
[H3O+(aq)] = 10–pH
[H3O+(aq)]
= 10–3,8 = 1,6´10–4 mol.L-1
3.2.
|
Équation chimique (1) |
|
NH3OH+(aq) + H2O(l) = NH2OH(aq) + H3O+(aq) |
|||
|
État du système |
Avancement (mol) |
Quantités de matière (mol) |
|||
|
État initial |
0 |
n0 |
Solvant |
0 |
0 |
|
État final réel |
xf |
n0 – xf |
Solvant |
xf |
xf |
|
État final si la réaction est totale |
xmax |
n0 – xmax =
0 |
Solvant |
xmax |
xmax |
3.3. taux
d’avancement final t
de cette réaction en fonction de no et nf (H3O+)
puis en fonction des concentrations molaires CA et [H3O+]f.
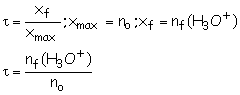
or n0 = CA.V et nf(H3O+)
= [H3O+(aq)]f.V
![]()
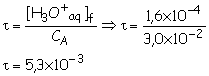
Le taux d’avancement final est inférieur à 1, la transformation est limitée ou partielle
3.4.
constante d’acidité KA de la réaction (1) NH3OH+(aq) + H2O(l) = NH2OH(aq) + H3O+(aq)

d’après (1), [H3O+(aq)]f
= [NH2OH(aq)]f = 10–pH.
Et d’après le tableau d’avancement [NH3OH+(aq)]f
= (no-xf)/V = CA – [H3O+(aq)]f,
ainsi ![]() =
= ![]()
KA = ![]() = 8,4´10–7
= 8,4´10–7
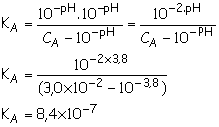
3.5
pKA = – logKA
pKA
= – log(8,4´10–7) = 6,1
Les deux valeurs obtenues sont quasi identiques (Données : pKA(NH3OH+(aq)
/ NH2OH(aq)) = 6,0).