Proportionalité entre conductivité et concentration
énoncé
CORRECTION :
1.
a- La fiole jaugée permet de prélever avec
une bonne précision 50 mL de solution. (0,5)
b- L’eau distillée évite
d’introduire d’autres ions présents dans l’eau du robinet. (0,5)
2.
Lors d’une dilution, il y a conservation de
la quantité de matière donc n = n0 . La valeur de la
concentration est donnée par : C = C0V0/V
|
V
(mL) |
50 |
100 |
150 |
200 |
250 |
300 |
350 |
400 |
|
C
(mmol.L-1) |
25,0 |
12,5 |
8,33 |
6,25 |
5,00 |
4,17 |
3,57 |
3,13 |
|
s (mS.cm-1) |
2800 |
1445 |
983 |
743 |
597 |
500 |
431 |
371 |
3.
Le graphique s = f(C) est pratiquement une droite passant par
l‘origine. Pour de faibles concentrations s est proportionnel à C. (s =
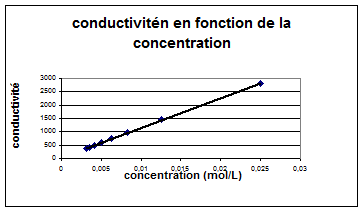
5. a- La conductivité d’une solution est donnée
par la relation : s
= S li
[Xi] soit s
= [liNa+
+ lCl-].C
b- C = 5,00 mmol.L-1 = 5,00 mol.m-3
A.N. : s = (5,01.10-3
+ 7,63.10-3)x5 = 6,32.10-2 S.m-1 = 6,32.10-4
S.cm-1 = 632 mS.cm-1
c-
La mesure a donnée : : s = 597 mS.cm-1
L’écart
relatif est ½Ds½/s = 632 – 597 /
597 = 6%. Cet écart est correct compte tenu de la précision des dilutions.